题目内容
【题目】直接用煤作家用燃料既污染空气又浪费能源。
(1)煤的气化是把煤变为清洁能源的重要一环,其中的一个反应是:C+H2O(g) ![]() CO+H2 , 该反应中表现出还原性的物质是。某能源物质燃烧的微观过程如下:
CO+H2 , 该反应中表现出还原性的物质是。某能源物质燃烧的微观过程如下: ![]()
若“ ![]() ”表示碳原子,“
”表示碳原子,“ ![]() ”表示氢原子,“
”表示氢原子,“ ![]() ”表示氧原子,该反应的生成物A应为(填字母序号)。
”表示氧原子,该反应的生成物A应为(填字母序号)。
A.CO B.CO2 C.CO2和CO
(2)酒精灯是实验室的常用热源,请写出酒精(C2H5OH)燃烧的化学方式程:。
(3)3.2g某物质完全燃烧产生4.4gCO2和3.6gH2O,没生成别的物质。该物质中C、H元素质量比为。该物质中(填“含”或“不含”)氧元素。
【答案】
(1)C,B
(2)C2H5OH+3O2 ![]() 2 CO2+3H2O
2 CO2+3H2O
(3)3:1,含
【解析】(1)在化学反应中能够夺取氧元素,具有还原性,故结合反应:C+H2O(g) ![]() CO+H2,该反应中表现出还原性的物质C;根据质量守恒定律的微观解释:在化学反应前后,原子的种类、个数都不变,根据化学反应的微观示意图,可判断反应的生成物A应为CO2,应选B(2)酒精(C2H5OH)燃烧的化学方程式:C2H5OH+3O2
CO+H2,该反应中表现出还原性的物质C;根据质量守恒定律的微观解释:在化学反应前后,原子的种类、个数都不变,根据化学反应的微观示意图,可判断反应的生成物A应为CO2,应选B(2)酒精(C2H5OH)燃烧的化学方程式:C2H5OH+3O2 ![]() 2 CO2+3H2O(3)根据质量守恒定律:化学反应前后,元素的种类、质量都不变,故4.4gCO2中所含的碳元素质量即为物质中所含的碳元素质量=4.4g×12/44×100%=1.2g,3.6gH2O中所含的氢元素质量即为物质中所含的氢元素质量=3.6g×2/18×100%=0.4g ,该物质中C、H元素质量比=1.2g:0.4g=3:1 ,由于碳元素质量1.2g+氢元素质量0.4g=1.6g<3.2g,故该物质中含氧元素
2 CO2+3H2O(3)根据质量守恒定律:化学反应前后,元素的种类、质量都不变,故4.4gCO2中所含的碳元素质量即为物质中所含的碳元素质量=4.4g×12/44×100%=1.2g,3.6gH2O中所含的氢元素质量即为物质中所含的氢元素质量=3.6g×2/18×100%=0.4g ,该物质中C、H元素质量比=1.2g:0.4g=3:1 ,由于碳元素质量1.2g+氢元素质量0.4g=1.6g<3.2g,故该物质中含氧元素
故答案为:(1)C;B;(2)C2H5OH+3O2 ![]() 2 CO2+3H2O;(3)3:1;含
2 CO2+3H2O;(3)3:1;含
(1)还原剂具有还原性,在反应中的氧,及化学反应前后原子种类和个数不变解答
(2)乙醇和氧气点燃生成二氧化碳和水
(3)根据元素的计算方法得出元素质量即可解答

【题目】下列数据是硝酸钾固体在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(1)硝酸钾溶液中的溶剂是 。
(2)20℃时,向100 g水中加入31.6 g硝酸钾,充分溶解后得到 (填“饱和”或“不饱和”)溶液。
(3)20℃时,向100 g水中加入40 g硝酸钾,若使硝酸钾完全溶解,可采用的方法是 。
(4)如图,小烧杯中盛放的是(2)中所得的硝酸钾溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是 (填字母)
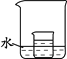
A.冰 B.浓硫酸 C.硝酸铵 D.干冰 E.氢氧化钠 F.氧化钙
(5)向一定量饱和的石灰水中加入少量的生石灰恢复到原温度,产生的现象是 ;其中改变的量是 。(提示:CaO+H2O→Ca(OH)2 )
A.溶质的质量 B.溶剂的质量 C.溶液的质量 D.溶质的质量分数