题目内容
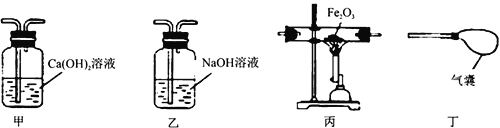
【题目】为了验证酸、碱、盐的化学性质,设计了三组实验,其中实验甲、乙中试管里面分别是氢氧化钠、氢氧化钙溶液。请回答下列问题:
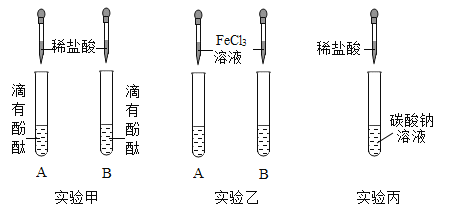
(1)实验甲中给试管中溶液滴入少量酚酞溶液的目的是_______。
(2)实验乙中共同的现象是______。
(3)实验丙中发生反应的化学方程式是 _____。
(4)三组实验中涉及的化合物的物质类别有___(不包括指示剂)类。
【答案】验证酸和碱确实发生了反应(合理即可) 有红褐色沉淀生成 Na2CO3+ 2HCl=2NaCl +H2O+CO2↑ 4
【解析】
(1)实验甲、乙中试管里面分别是氢氧化钠、氢氧化钙溶液,它们与稀盐酸反应没有明显现象,给氢氧化钠、氢氧化钙溶液中滴入无色酚酞溶液,溶液变红,再滴入稀盐酸,当观察到溶液恰好由红色变为无色时,说明酸和碱发生了中和反应。故填:验证酸和碱确实发生了反应;
(2)氯化铁溶液是黄色的,滴入可溶性碱溶液中,发生反应,生成红褐色的氢氧化铁沉淀。故填:有红褐色沉淀生成;
(3)实验丙中碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。故填:Na2CO3+ 2HCl=2NaCl +H2O+CO2↑;
(4)三组实验中涉及的物质有盐酸,属于酸类;氢氧化钠、氢氧化钙属于碱类;氯化铁和碳酸钠属于盐类;水属于氧化物,共有4类物质。故填:4。

【题目】实验室对一瓶未知溶质质量分数的H2SO4溶液进行测定,取20.0g硫酸样品于锥形瓶中,逐滴加入16%的NaOH溶液,并对溶液进行pH监测,所得数据如表所示:
滴加NaOH溶液的质量/g | 9.0 | 9.4 | 9.8 | 10.0 | 10.2 |
溶液的pH | 1.8 | 2.1 | 2.6 | 7.0 | 11.4 |
请回答:
(1)当滴加NaOH溶液的质量为9.4g时,溶液中的溶质是________。
(2)计算所测H2SO4溶液中溶质的质量分数。______