题目内容
【题目】向一定质量AgNO3、Cu(NO3)2、A1(NO3)3的混合溶液中加入Zn和Fe的混合物溶液质量随时间变化的关系如图所示。请回答下列问题:
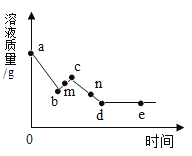
(1)请写出m点时发生反应的化学方程式_____。
(2)过滤得到n点时的固体,滴加稀盐酸可观察到什么现象_____?
(3)e点时溶液中一定含有的阳离子是什么_____?
【答案】Zn+Cu(NO3)2=Zn(NO3)2+Cu 有气泡生成,溶液变为浅绿色 铝离子、锌离子和亚铁离子
【解析】
在金属活动性顺序中,Al>Zn>Fe>Cu>Ag,向一定质量AgNO3、Cu(NO3)2、A1(NO3)3的混合溶液中加入Zn和Fe的混合物,锌先与硝酸银反应生成了硝酸锌和银,若硝酸银反应完全后,锌再与硝酸铜反应生成了硝酸锌和铜,若锌反应完全后铁再依次与硝酸银、硝酸铜反应,锌铁都不与硝酸铝反应。
![]()
所以析出银的过程是溶液质量减少的过程;
![]()
所以析出铜的过程是溶液质量增加的过程
![]()
所以析出铜的过程是溶液质量减小的过程,因此:ab是锌与硝酸银反应,bc是锌与硝酸铜反应,cd是铁与硝酸铜,从d开始反应停止了。
(1)在m点时,是锌与硫酸铜反应,化学方程式是:Zn+Cu(NO3)2=Zn(NO3)2+Cu;故填:Zn+Cu(NO3)2=Zn(NO3)2+Cu
(2)n点时,是铁与硝酸铜未反应完,过滤得到n点时的固体,固体中有铁,滴加稀盐酸可观察到有气泡生成,溶液变为浅绿色;故填:有气泡生成,溶液变为浅绿色
(3)e点时硝酸银、硝酸铜、锌完全反应,铁也参加了反应,所以应溶液中一定含有的铝离子、锌离子和亚铁离子,由于铁和硝酸铜反应中,没有具体说明是否完全反应,因此铜离子不一定有。故填:铝离子、锌离子和亚铁离子

练习册系列答案
相关题目