题目内容
某石灰厂需要测定产品生石灰中杂志的质量分数,小明进行了如图实验,请计算:
(1)生成CO2气体质量;
(2)样品中杂质的质量分数.

(1)生成CO2气体质量;
(2)样品中杂质的质量分数.

考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算样品中杂质的质量分数.
解答:解:(1)生成二氧化碳的质量为:10g+500g+100g-609.78g=0.22g,
答:生成二氧化碳的质量为0.22g.
(2)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 0.22g
=
,
x=0.5g,
样品中杂质的质量分数为:
×100%=5%,
答:样品中杂质的质量分数为5%.
答:生成二氧化碳的质量为0.22g.
(2)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 0.22g
| 100 |
| x |
| 44 |
| 0.22g |
x=0.5g,
样品中杂质的质量分数为:
| 0.5g |
| 10g |
答:样品中杂质的质量分数为5%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
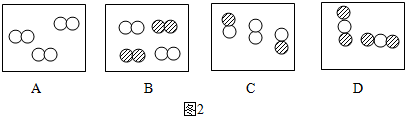
下列对相关实验现象的描述错误的是( )
| A、在淀粉溶液中滴加碘酒后溶液变蓝 |
| B、聚乙烯在空气中灼烧有刺激性气味 |
| C、硫在空气中燃烧产生淡蓝色火焰 |
| D、在稀硫酸中滴加紫色石蕊试液后溶液变红 |
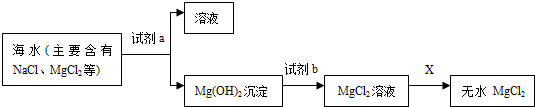
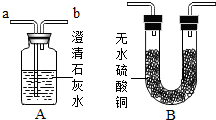 某学校化学课外活动小组,对铜制品生锈很感兴趣.经查阅资料,知道铜锈的主要成份是碱式碳酸铜,俗称铜绿,化学式为Cu2(OH)2CO3,他们在探究中发现,铜绿受热分解后,除生成二氧化碳和水蒸气外,试管中还有一些黑色粉末状固体,为了更清楚地了解这种黑色粉末,同学们准备通过实验探究,进一步分析黑色固体的组成,并验证产生的气体:
某学校化学课外活动小组,对铜制品生锈很感兴趣.经查阅资料,知道铜锈的主要成份是碱式碳酸铜,俗称铜绿,化学式为Cu2(OH)2CO3,他们在探究中发现,铜绿受热分解后,除生成二氧化碳和水蒸气外,试管中还有一些黑色粉末状固体,为了更清楚地了解这种黑色粉末,同学们准备通过实验探究,进一步分析黑色固体的组成,并验证产生的气体: .请回答:
.请回答: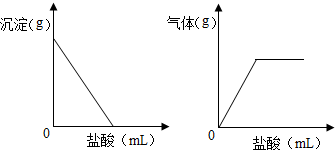 有一包色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此可以推断该包白色固体中:
有一包色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此可以推断该包白色固体中: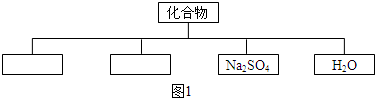
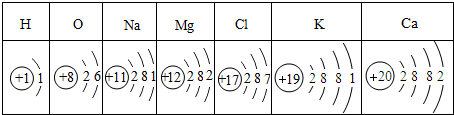
 ”和“
”和“ ”分别表示两种不同的原子,其中表示化合物的是
”分别表示两种不同的原子,其中表示化合物的是