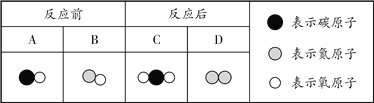
题目内容
【题目】学习酸碱盐知识后,兴趣小组同学开展了系列探究活动,请你一同参与。
活动探究一。甲组同学为了制取饱和石灰水,利用氧化钙设计了如下实验方案。
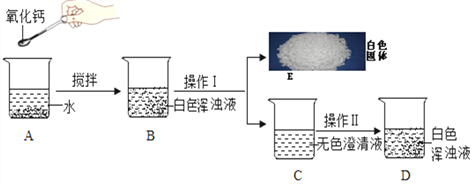
(1)A中发生反应的化学方程式为_______________________________,写出白色固体E的一种用途___________。
(2)如果要用实验证明C中不是水而是一种溶液,下列试剂无法完成实验的是___(填序号)。
①酚酞溶液 ②稀盐酸 ③二氧化碳
(3)若操作Ⅱ加入的是固体氢氧化钠(全部溶解),则产生白色浑浊的原因是___________。
活动探究二。乙组同学利用甲组制得的饱和澄清石灰水进行下图所示的实验,却未观察到预期现象。
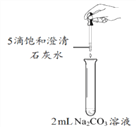
【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。
经讨论,同学们认为猜想①不合理,其理由是__________________________。
【进行实验】乙组同学针对猜想②进行实验。
实验目的 | 实验操作 | 实验现象 | |
碳酸钠溶液浓度/% | 是否浑浊 | ||
探究猜想② | 取4支试管,向其中分别加入2mL浓度为10%、5%、1%、0.5%的碳酸钠溶液,再分别滴加5滴饱和石灰水 | 10 | 不浑浊 |
5 | 不浑浊 | ||
1 | 浑浊 | ||
0.5 | 浑浊 | ||
【解释与结论】
(1)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是_______________________.
(2)乙组实验证明:猜想②________(填“成立”或“不成立”)。
【实验反思】丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:
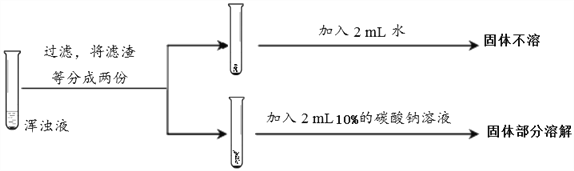
丙组同学运用的实验方法是________,得到的结论是___________________。
【答案】 CaO+H2O=Ca(OH)2 改良酸性土壤 ①③ 固体氢氧化钠溶解放出热量,氢氧化钙的溶解度随温度的升高而减小 饱和石灰水已是该温度下质量分数最大的溶液 Ca(OH)2+Na2CO3====CaCO3↓+2NaOH 不成立 对比试验,排除水的干扰 未观察到浑浊的原因与碳酸钠溶液的浓度有关
【解析】(1)氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2,氢氧化钙属于常见的碱,可以用来改良酸性土壤;(2)酚酞遇碱变红色,二氧化碳和氢氧化钙会生成碳酸钙沉淀,盐酸和氢氧化钙反应没有明显现象,氯化钠不会与氢氧化钙反应,故选①③;(3)氢氧化钙的溶解度随温度的升高而减小,由于固体氢氧化钠溶解放出热量,白色固体的化学式是Ca(OH)2;【猜想和假设】与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊,猜想错误,因为饱和石灰水已是该温度下质量分数最大的溶液;【解释与结论】(1) 氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式是:Ca(OH)2+Na2CO3====CaCO3↓+2NaOH;(2) 乙组实验证明:猜想②不成立;碳酸钠溶液浓度在0.510%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是碳酸钠溶液浓度大,不易产生浑浊;(3) 丙组同学运用的实验方法是对比试验,排除水的干扰,得到的结论是:未观察到浑浊的原因与碳酸钠溶液的浓度有关。

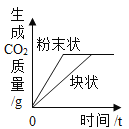
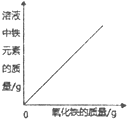
【题目】下列四个图像中,能正确反映对应变化关系的是
|
|
|
|
A. 向一定量的稀盐酸中加入氧化铁 | B. 向一定量的氢氧化钠溶液中滴加稀盐酸 | C. 向一定量的硫酸铜溶液中加入铁粉 | D. 向一定量的氢氧化钠和氢氧化钙的混合溶液中通入二氧化碳 |
A. A B. B C. C D. D