��Ŀ����
����Ŀ����������ʵ��������ȡ����ʱ���õ��������ش��������⡣
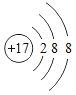
��1������E������Ϊ_____��
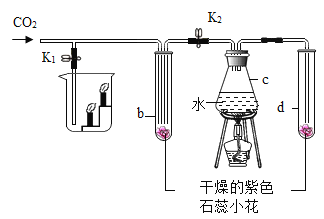
��2����ʵ�������5%�Ĺ���������Һ�Ͷ������̻����O2��������ˮ�������ռ���
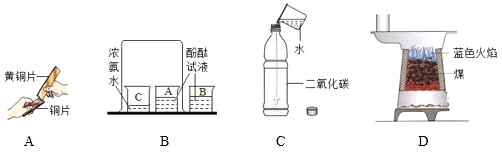
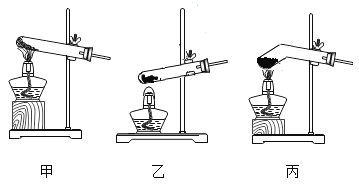
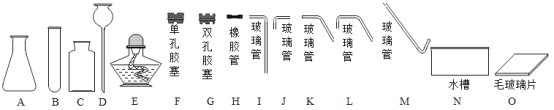
��Ӧѡ��ͼ��A��G��H��L��M��N��O��_____����װװ�á�
�ڵ��۲쵽����_____���ݳ���ʱ����ʼ�ռ�������
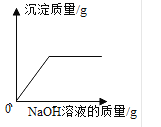
��3�����ü��ȸ�����صķ�����ȡ��������ͼ����ʾ�����⣬���貹��_____��
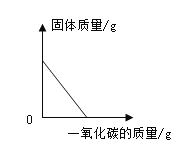
��4��С��ͬѧ��50g��̼���80%��ʯ��ʯ������ϡ���ᷴӦ�����ʲ����ᷴӦ��������CO2������Ϊ_____g��
���𰸡��ƾ��� C��D ������������ ����̨ 17.6
��������
��1����������������;��
��2����ȡװ�ð������ȺͲ���������֣������˫��ˮ�Ͷ��������������Ͳ���Ҫ���ȣ��������ܶȱȿ������ܶȴ�������ˮ��������������ſ���������ˮ���ռ���
��3������ø����������������Ҫ���ȣ����ü��ȸ�����صķ�����ȡ��������ͼ����ʾ�����⣬���貹������̨��
��4���йصļ���Ҫȷ��
��1���ƾ����dz��õļ����������ʴ�Ϊ���ƾ��ƣ�
��2����ʵ�������5%�Ĺ���������Һ�Ͷ������̻����O2��������ˮ�������ռ�����Ӧѡ��ͼ��A��G��H��L��M��N��O��C��D����װװ�ã��ڵ��۲쵽���ܿ��������������ݳ���ʱ����ʼ�ռ��������ʴ�Ϊ����C��D��ѡȫ���֣���ȫ����ȷ���÷֣��� �ڿ����������ȣ�
��3�����ü��ȸ�����صķ�����ȡ��������ͼ����ʾ�����⣬���貹������̨���ʴ�Ϊ������̨��
��4�������CO2������Ϊx��
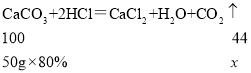
![]()
x��17.6g��
�𣺲���CO2������Ϊ17.6g��
�ʴ�Ϊ��17.6��

����Ŀ����ѧС�������е��������ʺܸ���Ȥ��������������ʽ���ʵ��̽����
��ʵ����ƣ���1����ʯ����Һ����ϡ�����У�Ԥ��ʯ����Һ����ɫ��__ɫ��
��2����ZnƬͶ��ϡ������,Ԥ�ƽ�����H2.
��ʵ����֤��ͬѧ�ǰ������������ʵ��,ȴ����ʯ���ɫ��һ�������ȥ,ZnƬͶ��ϡHNO3����Һ��ð�����ݣ�������ɫ����A�����Թܿ�A��ɺ���ɫ�д̼�����ζ������B.
��������⣩��1��ʯ����Һ��ɫ��Ϊ�λ���ɫ?
��2��������������ɫ������ʲô? ���������Щ����?
���������ϣ���������쳣����������ʦ��ָ���£�ͬѧ�������鵽���������ϣ�
��1���������Zn��Cu�ȶ��ֽ�����Ӧ������Ӧ��������,��������H2 .
��2������Ԫ�ص�ijЩ��̬���ʵ������������±���
NH3 | N2 | NO | NO2 | |
�ɫ | ��ɫ | ��ɫ | ��ɫ | ����ɫ |
�ܽ��� | ��������ˮ | ������ˮ | ������ˮ | ������ˮ������ |
�������������
��1��С��ͬѧ��Ϊʯ���ɫ������ɫ��ԭ���������Թܲ��ɾ�����������������ɵģ�Ҫ֤��С���Ĺ۵㣬Ӧ���еIJ�����______.
��2�����һ����ͬ�˺���ɫ����B��NO2����������ɫ����A����仯��ԭ���в�ͬ�Ŀ�����
��С��ͬѧ��ΪA��NH3�������һ�·��ԣ�ԭ����_________��
��Сǿͬѧ��ΪA��N2�����Ҳһ�·��ԣ�������__________��
������һ����A��NO�Ĺ�ʶ����ΪNO���Թܿ�����������NO2���÷�Ӧ����ʽΪ___
��ʵ��̽�����������ܷ���Cu��Ӧ��?С��ܸ���Ȥ,��ȡ��һС��ͭƬͶ��ϡHNO3��,����Cu�ܽ�,Ҳ��������Zn��ϡHNO3��Ӧ����������,ȷ֤������NO�����ǡ�÷�Ӧ��Cu��HNO3��������Ϊ8:21,�ɴ˻����Cu��ϡHNO3�ķ�Ӧ����ʽΪ______________.
�������뷴˼��ϡHCl��ͭ����Ӧ����Ϊͭ�Ľ�����Ա���__���������ǿ��������ϡHNO3ȴ�ܺ�ͭ��Ӧ����ΪϡHNO3����ǿ�������ԣ�����Cu����������ԭ��Ӧ������NO�����ʡ�