题目内容
【题目】杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,为能充分利用钾资源,用饱和的Ca(OH) 2溶液浸杂卤石制备硫酸钾,工艺流程如下: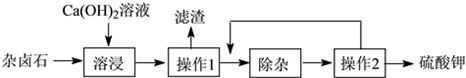
已知:
物质 | CaSO4 | K2SO4 | Mg(OH)2 |
溶解度/g(25℃) | 0.28 | 11.1 | 0.00084 |
(1)操作1的名称为 , 所需的玻璃仪器有玻璃棒、烧杯、 , 玻璃棒的作用是。
(2)滤渣的主要成分有和。
(3)“除杂”环节中,先加入 溶液(填字母,下同),经搅拌等操作后,过滤,再加入溶液调滤液pH至中性。
a. K2CO3 b. Na2CO3 c. 稀硫酸 d. 稀盐酸
(4)操作2的步骤是蒸发浓缩、、过滤、洗涤。
(5)洗涤硫酸钾最好选用。
a. 30℃的水 b. 饱和的硫酸钠溶液 c.饱和的硫酸钾溶液
【答案】
(1)过滤,漏斗,引流
(2)Mg(OH)2,CaSO4
(3)a,c
(4)降温结晶
(5)c
【解析】(1). 过滤能将难溶性固体与液体分离 (2). 过滤所需的玻璃仪器有玻璃棒、烧杯、漏斗,玻璃棒 (3). 过滤中玻璃棒的作用是引流,防止液体洒在过滤器外边。 (4). 氢氧化钙和氯化镁生成氢氧化镁沉淀,硫酸钙微溶,所以过滤后滤渣的主要成分是Mg(OH)2 和 CaSO4 (6). 滤液中的溶质为硫酸钾和少量的硫酸钙,所以除杂时应先加入碳酸钾,和硫酸钙反应生成碳酸钙沉淀和硫酸钾然后过滤, 再加入适量的硫酸将过量的碳酸钾转化成硫酸钾; (8). 操作2的步骤是蒸发浓缩、 降温结晶 过滤、洗涤 (9).为提高产率,洗涤硫酸钾最好选用饱和的硫酸钾溶液。
根据过滤的操作要求和注意事项分析,过滤为固体和液体分离的方法,所用仪器有玻璃棒、漏斗、滤纸和铁架台;根据反应后物质成分的确定方法分析,反应后物质成分除考虑生成物外还要考虑反应物是否有剩余。

 名校课堂系列答案
名校课堂系列答案