题目内容
【题目】为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算:
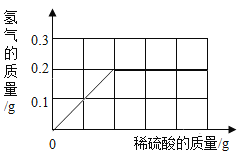
(1)生成氢气的质量为________。
(1)样品中铜的质量分数为________?
(2)反应所消耗的硫酸溶液质量为________?
【答案】 0.2 g 67.5% 100 g
【解析】本题考查了根据化学方程式进行计算。
(1)根据图像可知生成氢气质量为0.2g
设样品中锌的质量为x,同量消耗的硫酸质量为y。
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.2g
![]() =
=![]()
![]() =
=![]()
得x=6.5g,y=9.8g
样品中铜的质量为20g-6.5g=13.5g
(2)所以样品中锌的质量分数: ![]() ×100%=67.5%;
×100%=67.5%;
(3) 反应所消耗的硫酸溶液质量=![]() =100g
=100g

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
【题目】杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,为能充分利用钾资源,用饱和的Ca(OH) 2溶液浸杂卤石制备硫酸钾,工艺流程如下: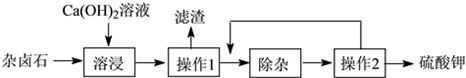
已知:
物质 | CaSO4 | K2SO4 | Mg(OH)2 |
溶解度/g(25℃) | 0.28 | 11.1 | 0.00084 |
(1)操作1的名称为 , 所需的玻璃仪器有玻璃棒、烧杯、 , 玻璃棒的作用是。
(2)滤渣的主要成分有和。
(3)“除杂”环节中,先加入 溶液(填字母,下同),经搅拌等操作后,过滤,再加入溶液调滤液pH至中性。
a. K2CO3 b. Na2CO3 c. 稀硫酸 d. 稀盐酸
(4)操作2的步骤是蒸发浓缩、、过滤、洗涤。
(5)洗涤硫酸钾最好选用。
a. 30℃的水 b. 饱和的硫酸钠溶液 c.饱和的硫酸钾溶液