题目内容
(2分)已知20℃时NaCl的溶解度是36.0g。某同学用天平称取NaCl固体25g,用量筒量取蒸馏水60mL(水的密度为1g/ mL),配制一定质量分数的氯化钠溶液,该氯化钠溶液的溶质质量分数为 。若该同学量取水时是俯视读数,则所配制氯化钠溶液的溶质质量分数会 (填“偏大”、“不变”、“偏小”)。
26.5% 不变
解析试题分析:已知20℃时NaCl的溶解度是36.0g。即在已知20℃时在100g水中最多溶解 NaCl 36.0g。所以在60g(60mL×1g/ mL)蒸馏水中最多溶解的氯化钠的质量为:60g×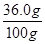 =21.6g。因此加入的25g无法完全溶解,溶液为饱和溶液。则溶液的溶质质量分数为:
=21.6g。因此加入的25g无法完全溶解,溶液为饱和溶液。则溶液的溶质质量分数为: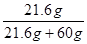 ×100%≈26.5%
×100%≈26.5%
若该同学量取水时是俯视读数,则所量取的水的体积比60mL小,所配制氯化钠溶液仍为饱和溶液,所以其溶质质量分数不变。
考点:溶解度的计算、溶质质量分数的计算、配制溶液时的误差分析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将100mL98%(密度1.84g/ mL)和100 mL水混合,所得溶液的溶质质量分数为( )
| A.49% | B.>49% | C.<49% | D.无法确定 |
现有溶质质量分数为8%的食盐水40g,要使溶液中氯化钠的质量分数达到20%,以下说法正确的是( )
| A.加入食盐4g | B.蒸发水分20g |
| C.蒸发水分24g | D.加入质量分数为25%的食盐水96g |
工业上以CaO和HNO3为原料制备Ca(NO3)2?6H2O晶体.为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为
| A.41.2% | B. 53.8% | C.58.3% | D.70.0% |
在某H2O2溶液中氢元素与氧元素的质量比为2:17,现向19g该H2O2溶液中加入1g二氧化锰,充分反应后,生成氧气的质量为
( )
| A.1g | B.1.6g | C.4.2g | D.8.5g |