题目内容
【题目】日常生活中,每位同学都会接触到硬水。某化学兴趣小组同学对硬水进行了些探究实验,请完成填空(序数标号处)。
(查阅资料)水的硬度是由水中溶解的可溶性钙和镁化合物引起的。
(1)日常生活中常用煮沸的方法将硬水软化,这种方法可靠吗?小组同学设计了如下实验。
序号 | 实验操作 | 实验现象 |
Ⅰ | 分别取适量碳酸氢钙溶液于A、B两支试管中,加热A试管,B试管不加热。 | A试管中产生气泡,有沉淀生成,B试管中无明显现象。 |
Ⅱ | A试管冷却后,在上述两支试管中,分别滴加几滴肥皂水,振荡。 | _____(填“A”或“B”)试管中有较多泡沫,另一支试管中泡沫较少。 |
实验结论是:________。
(2)小组同学对某硬水中为什么含有碳酸氢钙非常感兴趣,在学习九年级化学上册课本中的“溶洞的形成”后知道:当石灰岩遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:![]() 。小组同学向碳酸钠溶液中通入一定量的二氧化碳,所得溶液的溶质是什么?于是他们对此开展实验探究(不考虑二氧化碳和碳酸作为溶质的情况)
。小组同学向碳酸钠溶液中通入一定量的二氧化碳,所得溶液的溶质是什么?于是他们对此开展实验探究(不考虑二氧化碳和碳酸作为溶质的情况)
(提出猜想)猜想一:溶质为Na2CO3;猜想二:溶质为 NaHCO3;猜想三:溶质为______。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
a.取碳酸钠溶液通入一定量二氧化碳后所得的溶液少许于试管中,向其中滴加过量的CaCl2溶液 | 有白色沉淀生成 | 猜想二_____(填“成立”或“不成立”) |
b.取实验步骤a试管中的上层清液,滴加适量稀盐酸 | 有气泡冒出 | ______不成立 |
写出实验步骤a中发生反应的化学方程式______________。
通过实验,小组同学得出了正确结论。
(拓展延伸)将8.0g NaOH固体溶解在100mL水中,通入6.6g二氧化碳气体,充分反应后,所得溶液中溶质 NaHCO3的质量为___________。
【答案】A 用煮沸的方法可以降低水的硬度 Na2CO3和NaHCO3 不成立 猜想一 ![]() 8.4
8.4
【解析】
[查阅资料]
肥皂水可以区分硬水和软水,泡沫多的是软水,泡沫少的是硬水;分别向两支试管加入肥皂水,A中出现较多泡沫,B中较少;可证明煮沸可以将硬水软化;
[提出猜想]
向碳酸钠溶液中通入一定量的二氧化碳,所得溶液中溶质有以下几种情况:
①碳酸钠不和二氧化碳、水反应,溶质是碳酸钠;
②部分碳酸钠和二氧化碳、水反应,溶质是Na2CO3和NaHCO3;
③全部碳酸钠和二氧化碳、水反应,溶质是碳酸氢钠;
故猜想三:溶质为碳酸氢钠和碳酸钠;
[设计实验]
a.取所得溶液少许于试管中,向其中滴加过量的CaCl2溶液,有白色沉淀生成,溶液中一定有碳酸钠;猜想二不成立; 碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,方程式为:![]() ;
;
b.取实验步骤a中上层清液,滴加适量稀盐酸,有气泡冒出,说明溶液中含有碳酸氢钠(a中已经加入过量的氯化钙会把碳酸钠全部反应完,此处产生气体不会是碳酸钠与稀盐酸反应生成的),则猜想一不成立;碳酸氢钠和稀盐酸能反应生成氯化钠、水和二氧化碳;
[拓展延伸]
通入的二氧化碳与氢氧化钠反应生成碳酸钠和水,设8g氢氧化钠消耗二氧化碳质量为x,生成碳酸钠质量为y

![]()
x=4.4g,y=10.6g
共通入二氧化碳6.6g,相当于向含有10.6g碳酸钠溶质的溶液中再通入2.2g二氧化碳,
由反应中各物质质量关系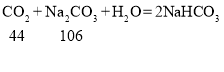 可知每44份质量的二氧化碳与106份质量的碳酸钠恰好反应,可得2.2g二氧化碳最多能消耗5.3g碳酸钠,即二氧化碳不足量,生成碳酸氢钠质量按二氧化碳质量计算,设生成碳酸氢钠的质量为z
可知每44份质量的二氧化碳与106份质量的碳酸钠恰好反应,可得2.2g二氧化碳最多能消耗5.3g碳酸钠,即二氧化碳不足量,生成碳酸氢钠质量按二氧化碳质量计算,设生成碳酸氢钠的质量为z
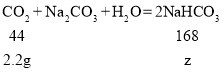
![]() 8
8
z=8.4g,即所得溶液中溶质NaHCO3的质量为8.4g。

 综合自测系列答案
综合自测系列答案