题目内容
【题目】工业炼铁是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来。
(1)通入空气使固态的焦炭转化为具有还原性的气态物质,转化过程中涉及的反应的化学方程式是______________________。
(2)赤铁矿(主要成分为Fe2O3 )在高炉里反应生成单质铁的化学方程式是______________________。
(3)汁算:
①氧化铁(Fe2O3)的相对分子质量是_________________________________;
②5000t含氧化铁84%的赤铁矿中,氧化铁的质量是__________________t;
③上述赤铁矿理论上可炼得含铁98%的生铁_________________________t。
【答案】C+O2![]() CO2 ,CO2+C
CO2 ,CO2+C![]() 2CO Fe2O3+3CO
2CO Fe2O3+3CO![]() 2Fe+3CO2 160 4200 3000
2Fe+3CO2 160 4200 3000
【解析】
(1)焦炭在空气为燃烧生成二氧化碳,生成的二氧化碳在高温条件下与焦炭发生反应,生成具有还原性的气体一氧化碳;
故答案为:C+O2![]() CO2,CO2+C
CO2,CO2+C![]() 2CO;
2CO;
(2)在高温条件下,一氧化碳还原氧化铁得到单质铁和二氧化碳;
故答案为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)氧化铁(Fe2O3)的相对分子质量=56×2+16×3=160
5000t含氧化铁84%的赤铁矿中,氧化铁的质量=5000t×84%=4200t
5000t赤铁矿中含铁元素的质量=4200t×![]() ×100%=2940t
×100%=2940t
理论上可炼得含铁98%的生铁的质量=![]() =3000t
=3000t
故答案为:①160;②4200;③3000.

 天天练口算系列答案
天天练口算系列答案【题目】工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:
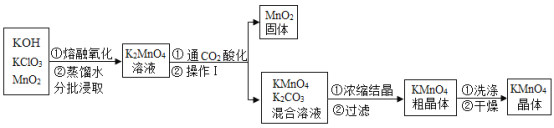
资料查阅:已知相关物质的溶解度(20℃)如下表
物质 | K2CO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 11.1 | 6.34 |
(1)KMnO4中锰元素的化合价为_____。上述流程中可循环利用的物质是_____
(2)“干燥”过程中温度不宜过高的原因是(用化学方程式表示)_____
(3)结合流程和有关信息,补充完整由KMnO4和K2CO3混合溶液中结晶得到KMnO4晶体的实验方案:蒸发浓缩、_____、过滤、洗涤、干燥。
(4)“通CO2酸化”,反应的化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3,若用稀硫酸酸化,反应的化学方程式为:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2X,则X的化学式为_____,工业上不采用稀硫酸酸化的的原因是_____
【题目】学习了二氧化锰对过氧化氢有催化作用的知识后,某同学想:氧化铜(CuO)能否起到类似二氧化锰的作用呢?进行了如下探究。
(猜想)Ⅰ.CuO 不是催化剂、也不参与反应,反应前后质量和化学性质不变
Ⅱ.CuO参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后______________;
(实验)用天平称量0.2g CuO,取5mL15%的过氧化氢溶液于试管中,进行如下实验:
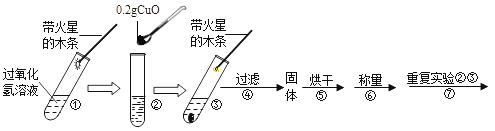
(1)将猜想III补充完整:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出,带火星的木条复燃 | ____________ | __________ | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立 |
(2)步骤①的目的____________
(3)过氧化氢能被CuO催化分解放出氧气的反应文字表达式为________________