题目内容
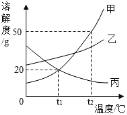
【题目】如图是一些物质的溶解度曲线。

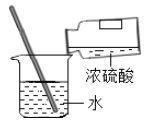
【1】在20℃时,向盛有100g水的烧杯中加入25gKNO3搅拌,观察到的现象是 ;该溶液的溶质是 。
【2】往(1)的烧杯中再加入25gKNO3搅拌,有 克KNO3固体没有溶解,此时所得的溶液是 (“饱和”或“不饱和”)溶液。
【3】在(2)所得的溶液中KNO3的质量是 g。
【4】KNO3溶液中含有少量NaCl时,提纯的方法是
【答案】
【1】KNO3(固体)完全溶解(1分) KNO3(硝酸钾)(1分)
【2】18.4g(1分) 饱和(1分)
【3】31.6g(1分)
【4】冷却热的KNO3饱和溶液(1分)
【解析】
1)由图像可知20℃时KNO3的溶解度为31.6g,所以在100g水中最多可以溶解31.6克硝酸钾,故加入25gKNO3,可以完全溶解,(2)再加入25gKNO3时,只能再溶解6.6g,所以有25-6.6=18.4克固体没有溶解,不能在溶解硝酸钾固体了,所以此时溶液为饱和溶液,(3)此时在(2)所得的溶液中KNO3的质量是31.6g。(4)NaCl的溶解度受温度影响很小,KNO3的溶解度受温度影响很大,故可以冷却热的KNO3饱和溶液来提纯硝酸钾。

【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。根据表中信息判断下列说法正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 2 | 90 | 20 | 10 |
反应后的质量/g | m | 39 | 5 | 16 |
A.反应后![]() 的数值为0B.甲一定是该反应的催化剂
的数值为0B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为![]() D.丙可能是单质
D.丙可能是单质
【题目】实验中小明手遇高锰酸钾后皮肤变色了,于是对高锰酸钾的腐蚀性展开研究。
(实验1)20C时将相同大小的新鲜鸡皮在不同浓度的高锰酸钾溶液中浸泡相同时间,现象如下表。
溶液中高锰酸钾的质量分数 | 0.002% | 0.01% | 0.1% | 1% |
鸡肉皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
(实验2)20℃时将相同大小的铜片分别在4种液体中浸泡相同时间后,测铜片质量变化,数据如下表。
试验编号 | ① | ② | ③ | ④ | |
实验用的溶液 | 25 mL 0.1%高锰酸钾溶液 | 25mL 0.1%高锰酸钾溶液 | 25 mL蒸馏水+10滴浓硫酸 | 25mL1%高锰酸钾溶液+10滴浓硫酸 | |
铜片质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.42 | |
回答下列问题:
(1)实验1的目的是_______________。若要证明温度对0.05%的高锰酸钾溶液腐蚀鸡皮的影响,你设计的实验是__________________.
(2)实验2中通过对比②和④,得出的结论是___________
(3)实验2中,欲得出“高锰酸钾和硫酸共同作用对铜才有腐蚀性”的结论,需要对比的实验是_______________(填实验编号)。
【题目】某小组同学在实验室进行实验,请你参与。
(1)同学们先取少量在空气中久置的氢氧化钠固体样品加水配制成溶液,另取2mL该溶液于小烧杯中,然后滴加几滴酚酞溶液,振荡,此时观察到的实验现象为:_____________________。接着向烧杯中逐滴加入稀盐酸并用玻璃棒搅拌,溶液的颜色改变,同时观察到有气泡产生。结论:氢氧化钠变质。请化学方程式解释氢氧化钠变质的原因:_____________________。
(2)针对氢氧化钠变质的程度做了进一步探究。
(作出猜想)猜想一:样品部分变质,成分为NaOH、Na2CO3;
猜想二:样品完全变质,成分为_______________。
(查阅资料)①BaCl2溶液显中性,BaCO3难溶于水。②向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,会发生生成碳酸氢钠和氯化钠的反应。
(实验探究)为验证猜想,同学们设计了两个方案,并进行实验。
①定性方案设计,请你将该实验设计补充完整。
实验内容 | 实验现象 | 得出结论 |
取少量样品溶液,加入足量BaCl2溶液,静置,向上层清液中滴加几滴无色酚酞溶液 | ______________ | 猜想一正确 |
②定量方案设计 先准确称取 11.95g 变质的NaOH样品放入锥形瓶中,用电子秤称得锥形瓶及样品的总质量为46.95g,再把 150.00 g7.3 %稀盐酸平均分成 6等份,每份25.00g依次在充分摇动锥形瓶时,加入样品中,每次充分反应后用电子秤称得锥形瓶及所盛物质的质量,实验数据记录如下:
加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 |
锥形瓶及所盛物质总质量/g | 71.95 | 96.95 | 120.85 | 144.75 | 168.65 | 193.65 |
(实验结论)请根据上述实验数据,计算样品中氢氧化钠的质量分数为______(精确到0.1%),猜想一正确。
(反思交流)
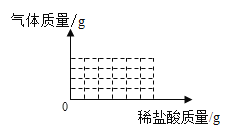
①在如图的直角坐标系中画出产生气体的质量与所加稀盐酸质量的关系曲线______。
②请判断第二次加入盐酸过程中发生反应的化学方程式_________________,原因______________________。