题目内容
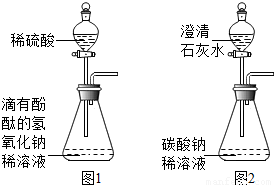
某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:CaSO4微溶,但在稀溶液中看作可溶,其水溶液呈中性.)(1)甲、乙两同学想用实验证明稀硫酸和NaOH稀溶液确实能发生反应,设计了如图1所示的实验.丙、丁两同学想再现课本上将“澄清石灰水滴入Na2CO3溶液”
的实验现象,设计了如图2所示的实验.并各自进行操作.
【问题讨论】教师首先肯定了这四位同学的实验设计和操作,请你填空:甲、乙同学将较多量的稀硫酸加入锥形瓶后,他们是依据溶液的颜色由______色变为______色的现象来判断两者确实发生反应的.丙、丁同学的实验中发生的复分解反应可用化学方程式表示为______.
【意外发现】甲同学和丙同学在洗刷仪器前,将图1、2装置锥形瓶中的残留物倒入同一个洁净的废液缸,发现白色沉淀溶解,有气泡产生,废液缸中形成无色溶液.这一现象立刻引起了同学们的好奇,于是,他们又以“无色溶液中含有哪些溶质”为课题进行探究.
【提出猜想】经讨论呈现出如下猜想:
①溶质为:Na2SO4、CaSO4 ②溶质为:Na2SO4、CaSO4、H2SO4 ③溶质为:Na2SO4、CaSO4、NaOH
请你判断:上述猜想中不合理的是______(填数字代号).
【实验探究】小组同学针对认为合理的猜想,设计实验进行探究,请你将下表补充完整.
| 实验内容 | 实验现象和结论 |
| 取废液缸中少量溶液于试管中, 滴入少量______溶液,观察 | a.若有气泡产生,则猜想______成立(填数字代号) |
| b.若无气泡产生,则猜想______成立(填数字代号) |
【答案】分析:根据常见酸碱指示剂遇酸性物质和碱性物质的变色情况来判断溶液颜色的变化;依据复分解反应的特征写出化学方程式;依据含有酚酞试液的溶液为无色,排除猜想③,比较猜想①②找出区别进行检验;根据质量守恒定律来推测反应后物质的可能情况.
解答:解:(1)【问题讨论】由于氢氧化钠溶液呈碱性,能使无色酚酞试液变为红色,加入稀硫酸会与氢氧化钠反应生成显中性的氯化钠,故溶液的颜色会由红色变为无色;澄清石灰水的主要成分氢氧化钙会与碳酸钠溶液反应生成白色的碳酸钙沉淀和氢氧化钠.化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
故答案为:浅红(红);无;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
【提出猜想】根据A、B装置锥形瓶中的残留物混合后形成无色溶液,可知溶液中不存在显碱性的物质.故猜想③不合理.
故答案为:③.
【实验探究】猜想①②中的不同点在于是否含有硫酸,故我们只要检验其中是否含有硫酸即可得出结论,故可选用活泼金属或碳酸盐来进行验证.
故答案为:Na2CO3(或镁条、铁钉等);②;①.
点评:本题主要考查了酸、碱、盐之间相互反应方面的知识,综合性较强,要求解题是思路比较清楚.试题难度较大.
解答:解:(1)【问题讨论】由于氢氧化钠溶液呈碱性,能使无色酚酞试液变为红色,加入稀硫酸会与氢氧化钠反应生成显中性的氯化钠,故溶液的颜色会由红色变为无色;澄清石灰水的主要成分氢氧化钙会与碳酸钠溶液反应生成白色的碳酸钙沉淀和氢氧化钠.化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
故答案为:浅红(红);无;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
【提出猜想】根据A、B装置锥形瓶中的残留物混合后形成无色溶液,可知溶液中不存在显碱性的物质.故猜想③不合理.
故答案为:③.
【实验探究】猜想①②中的不同点在于是否含有硫酸,故我们只要检验其中是否含有硫酸即可得出结论,故可选用活泼金属或碳酸盐来进行验证.
故答案为:Na2CO3(或镁条、铁钉等);②;①.
点评:本题主要考查了酸、碱、盐之间相互反应方面的知识,综合性较强,要求解题是思路比较清楚.试题难度较大.

练习册系列答案
相关题目

 (2012?姜堰市二模)某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:CaSO4微溶,但在稀溶液中看作可溶,其水溶液呈中性.)
(2012?姜堰市二模)某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:CaSO4微溶,但在稀溶液中看作可溶,其水溶液呈中性.)