题目内容
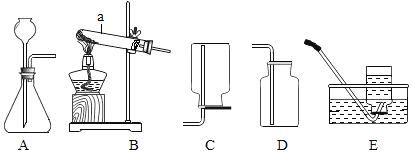
【题目】高阳同学通过阅读课外资料得知,潜水艇中常用过氧化钠(Na2O2)作为供氧剂,有关反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,2Na2O2+2H2O═4NaOH+O2↑。于是她用如图所的装置来制取CO2并验证其与Na2O2的反应。
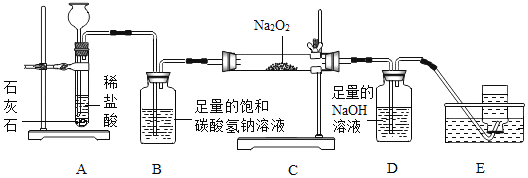
(1)装置B的作用是_____。
(2)反应一段时间后,装置E中收集到的气体主要是_____;反应后装置C硬质玻璃管中固体的成分是什么?高阳为此又进行了如下探究:
(猜想与假设)
猜想一 Na2CO3
猜想二Na2CO3和Na2O2
猜想三Na2CO3和NaOH
你认为还可能是_____
(设计实验)
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的水,振荡 | 固体完全溶解,_____ | 样品中一定没有Na2O2 |
②取少量实验①所得溶液于另一试管中,加入过量的BaCl2溶液,振荡 | 有白色沉淀产生 | 猜想三正确 |
③取少量实验②所得上层清液于另一试管中,加入_____溶液,振荡 | 有白色沉淀产生 |
(反思与评价)反应后装置C硬质玻璃管中的固体含有NaOH,原因可能是_____。
【答案】吸收氯化氢气体 氧气 Na2O2、Na2CO3和NaOH 不产生气泡 氯化镁 二氧化碳通过B装置带出水蒸气,和过氧化钠反应生成氢氧化钠
【解析】
A装置为二氧化碳的发生装置,B装置为除杂装置,目的是除去二氧化碳中混有的氯化氢气体,C装置为二氧化碳和过氧化钠的反应装置,注意气体进入C装置之前并没有干燥,因此气体中含有水分,C装置中还有副反应发生,即过氧化钠与水反应生成氢氧化钠和氧气,D装置为二氧化碳的吸收装置,最后E装置用排水法收集到氧气。因为装置C有副反应发生,就为C装置的固体成分探究提供了线索,利用各种物质的不同性质,选择合适的试剂进行探究。最后的反思与交流则是对探究实验正确科学的态度的体现。
(1)装置B的作用是吸收氯化氢气体。
(2)反应一段时间后,装置E中收集到的气体主要是氧气;
[猜想与假设]
猜想一:过氧化钠完全和二氧化碳反应时是 Na2CO3
猜想二:过氧化钠过量时是Na2CO3和Na2O2
猜想三:二氧化碳中含有水蒸气时是Na2CO3和NaOH
过氧化钠过量、二氧化碳中含有水蒸气时是Na2O2、Na2CO3和NaOH。
【设计实验】
①取少量样品于试管中,加入足量的水,振荡,固体完全溶解,不产生气泡,说明固体中一定没有过氧化钠;
②取少量实验①所得溶液于另一试管中,加入过量的BaCl2溶液,振荡,产生白色沉淀,是因为碳酸钠和氯化钡反应生成了白色沉淀碳酸钡;
③取少量实验②所得上层清液于另一试管中,加入氯化镁溶液,振荡,产生白色沉淀,是因为氢氧化钠和氯化镁反应生成了白色沉淀氢氧化镁,实验过程如下所示:
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的水,振荡 | 固体完全溶解,不产生气泡 | 样品中一定没有Na2O2 |
②取少量实验①所得溶液于另一试管中,加入过量的BaCl2溶液,振荡 | 有白色沉淀产生 | 猜想三正确 |
③取少量实验②所得上层清液于另一试管中,加入氯化镁溶液,振荡 | 有白色沉淀产生 |
[反思与评价]
反应后装置C硬质玻璃管中的固体含有NaOH,原因可能是二氧化碳通过B装置带出水蒸气,和过氧化钠反应生成氢氧化钠。

【题目】下列除去杂质所选用的试剂正确的是( )
选项 | 物质 | 杂质(少量) | 除杂试剂 |
A | N2 | O2 | 灼热的铜网 |
B | CaO | Ca(OH)2 | 水 |
C | NaCl溶液 | Na2SO4 | Ba(NO3)2溶液 |
D | FeSO4溶液 | CuSO4 | 锌粉 |
A. AB. BC. CD. D
【题目】2019年为“元素周期表年”,元素周期表是学习和研究化学的重要工具。
(1)原子序数为1~18的元素在元素周期表中的位置如下表所示。
第1周期 | H | He | ||||||
第2周期 | Li | Be | B | C | N | O | F | Ne |
第3周期 | Na | Mg | Al | Si | P | S | Cl | Ar |
①Al属于_____(填“金属”或“非金属”)元素,其原子的核电荷数为______
②Na原子的结构示意图为 ,则钠离子的核外电子数为_______。
,则钠离子的核外电子数为_______。
③周期表中磷元素的有关信息如图所示,图中“30.97”所表示的含义是_______.

(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价一物质类别”关系图。
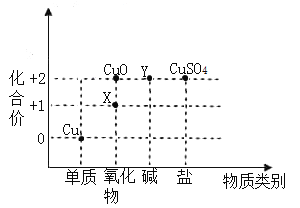
①写出物质X的化学式:_____。
②写出由物质Y转化为![]() 的化学反应方程式:______.
的化学反应方程式:______.