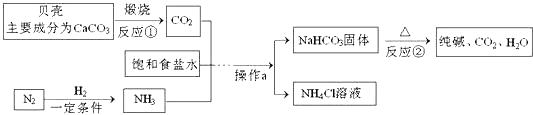
题目内容
【题目】某化学兴趣小组的同学在做氢氧化钙与稀盐酸中和反应的实验时,忘记滴加指示剂,因而无法判断酸碱是否恰好完全反应。于是他们对反应后溶液中的溶质大胆提出猜想,进行了以下探究,请你和他们一起完成下列实验报告。
Ⅰ.定性探究
【提出问题】该溶液中的溶质含有哪些成分?
【查阅资料】CaCl2溶液呈中性。
(1)【猜想与假设】
猜想Ⅰ:溶液中的溶质只有
猜想Ⅱ:溶液中的溶质有CaCl2、HCl
猜想Ⅲ:溶液中的溶质有CaCl2、Ca(OH)2
猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl
(2)请写出该反应的化学方程式。经过讨论,同学们直接得出不合理的猜想是哪一种并说出理由。为了验证余下的哪一种猜想是正确的,同学们又做了以下实验。
(3)【进行实验】
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞溶液 | 猜想Ⅲ不正确 | |
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钠 | 有气泡产生 | 猜想不正确 |
(4)操作②有气泡生成的化学方程式为。
(5)下列曲线能够表示所做实验中溶液pH变化趋势的是 (填序号)。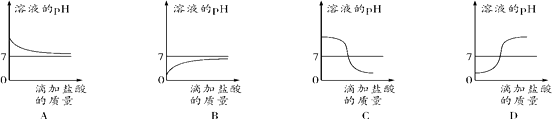
(6)【反思交流】
要使烧杯内溶液的溶质只含CaCl2 , 需要除去杂质,其中的一种方法是向烧杯中加入过量的 , 然后过滤。
(7)II.定量探究
兴趣小组同学想对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为20%的氢氧化钙溶液进行中和,如下图所示.请你计算废水中盐酸的溶质质量分数(写出具体的计算过程)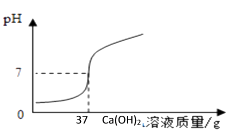
【答案】
(1)CaCl2
(2)2HCl+ Ca(OH)2= CaCl2+2H2O,HCl与 Ca(OH)2不能共存
(3)不变色,Ⅲ,Ⅱ
(4)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(5)D
(6)碳酸钙
(7)解∶设参加反应的HCl质量为xg
2HCl+ | Ca(OH)2= CaCl2+2H2O |
73 | 74 |
x | 20%×37g |
![]() =
= ![]()
x=7.3g.
废水中盐酸的溶质质量分数∶ ![]() ×100%=14.6%。
×100%=14.6%。
答∶废水中盐酸的溶质质量分数是14.6%。
【解析】Ⅰ.定性探究【提出问题】该溶液中的溶质含有哪些成分?【查阅资料】CaCl2溶液呈中性.猜想Ⅰ:溶液中的溶质只有CaCl2.猜想Ⅱ:溶液中的溶质有CaCl2、HCl.猜想Ⅲ:溶液中的溶质有CaCl2、Ca(OH)2.猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl.
该反应的化学方程式是2HCl+ Ca(OH)2= CaCl2+2H2O,经过讨论,同学们直接得出不合理的猜想是猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl,理由是HCl与 Ca(OH)2不能共存,为了验证余下的哪一种猜想是正确的,【进行实验】
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞溶液 | 不变色 | 猜想Ⅲ不正确 |
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钠 | 有气泡产生 | 猜想Ⅲ不正确 猜想Ⅱ正确 |
(4)操作②有气泡生成的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(5)下列曲线能够表示所做实验中溶液pH变化趋势的是D;
【反思交流】(6)要使烧杯内溶液的溶质只含CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的碳酸钙,然后过滤;
(7)根据氢氧化钙的质量进行计算.
所以答案是:CaCl2;2HCl+ Ca(OH)2= CaCl2+2H2O;HCl与 Ca(OH)2不能共存;不变色;Ⅲ;Ⅱ;Na2CO3+2HCl=2NaCl+H2O+CO2↑;D;碳酸钙;14.6%.

【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度 |
① | KClO3 | 580℃ |
② | KClO3、MnO2(质量比1:1) | 350℃ |
③ | KClO3、CuO(质量比l:1) | 370℃ |
④ | KClO3、Fe2O3(质量比1:1) | 390℃ |
【分析数据、得出结论】
(1)由实验 __________ 与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是 ________ 。
(3)若Fe2O3是该反应的催化剂,请写出这个反应的符号表达式 _________________________ 。
(4)如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据。
二氧化锰与氯酸钾的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 |
①据如表可知二氧化锰与氯酸钾的质量比为 _______________ 时,反应速率最快;
②通过分析可知,在化学反应中催化剂的用量 __________ 越多越好。(填“是”或“不是”)
③二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的 __________ ,所以反应速率受到影响。