题目内容
【题目】(10分)黄铜矿(主要万分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图所示:
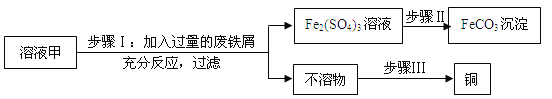
(1)Fe2(SO4)3与铁反应的化学方程式: x Fe2(SO4)3+ y Fe= z FeSO4,其中x、y、z为化学计量数,z的值为_____________。
(2)步骤Ⅰ中,生成铜的化学方程式:__________________________。
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是______________________。
(4)步骤Ⅱ中加入一种可溶性可实现其转化,从复分解反应发生的条件分析,该试剂可以是________。
(5)步骤Ⅲ回收铜的方法为___________________。
【答案】(1)3;(2)Fe+CuSO4==Cu+FeSO4 (3)金属铁能与铁盐反应转化为亚铁盐;
(4)碳酸氢铵溶液(5)加入稀硫酸过滤。
【解析】
试题分析:(1)根据氧化还原反应中得失电子数相等,得z的值为3;(2)步骤Ⅰ中,生成铜的化学方程式:Fe+CuSO4==Cu+FeSO4(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是金属铁能与铁盐反应转化为亚铁盐;(4)步骤Ⅱ中加入一种可溶性可实现其转化,从复分解反应发生的条件分析,该试剂可以是碳酸氢铵溶液;(5)步骤Ⅲ回收铜的方法为加入稀硫酸过滤。

练习册系列答案
相关题目