题目内容
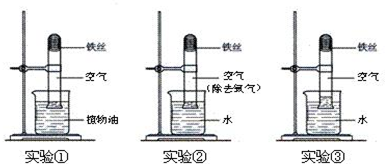 在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整.
在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整.实验目的:铁生锈条件的探究.
实验内容:取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象.
实验现象:实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小.
实验结论:铁生锈实际上是铁与空气中的
氧气
氧气
、水
水
(填名称)发生反应的结果.实验思考:
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的
五分之一
五分之一
.(2)该实验创新之处在于:可根据铁丝表面的铁锈和
进入试管内的水的体积
进入试管内的水的体积
两种现象来判断铁丝反应进行的情况.(3)用完的菜刀要擦干存放,理由是
除去水,防止生锈
除去水,防止生锈
.(4)铝比铁活泼,但铝难腐蚀,原因是
铝易生成一层致密的氧化物保护膜,阻止铝进一步反应
铝易生成一层致密的氧化物保护膜,阻止铝进一步反应
.(5)铁锈的主要成分是
氧化铁
氧化铁
,铁在氧气中燃烧的化学方程式是3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
分析:钢铁生锈的条件是钢铁与氧气和水同时接触.
(1)根据氧气约占空气总体积的五分之一分析.
(2)选择实验中的现象分析铁丝反应进行的情况.
(3)隔绝水或氧气能够防止铁生锈.
(4)铝的化学性质比较活泼,能和氧气反应生成一层致密而坚硬的氧化物薄膜,从而阻止铝的进一步反应.
(5)根据铁锈的主要成分、铁丝燃烧结合化学方程式书写分析.
(1)根据氧气约占空气总体积的五分之一分析.
(2)选择实验中的现象分析铁丝反应进行的情况.
(3)隔绝水或氧气能够防止铁生锈.
(4)铝的化学性质比较活泼,能和氧气反应生成一层致密而坚硬的氧化物薄膜,从而阻止铝的进一步反应.
(5)根据铁锈的主要成分、铁丝燃烧结合化学方程式书写分析.
解答:解:实验结论:实验①②无明显现象,实验③中铁丝生锈,说明铁与氧气和水充分接触时容易生锈.
故答案为:氧气;水;
实验思考:
(1)因为氧气约占空气总体积的五分之一,当试管中的氧气被消耗完后,进入试管内的水的体积约占试管体积的五分之一.
故答案为:五分之一;
(2)该实验创新之处在于:可根据铁丝表面的铁锈和试管内空气体积减小两种现象来判断铁丝反应进行的情况.
故答案为:进入试管内的水的体积;
(3)在干燥的环境中可以防止菜刀生锈.
故答案为:除去水,防止生锈;
(4)铝比铁活泼,但铝难腐蚀,原因是铝易生成一层致密的氧化物保护膜,阻止铝进一步反应.
故答案为:铝易生成一层致密的氧化物保护膜,阻止铝进一步反应;
(5)铁锈的主要成分是氧化铁,铁在氧气中燃烧的化学方程式是3Fe+2O2
Fe3O4.
故答案为:氧化铁;3Fe+2O2
Fe3O4.
故答案为:氧气;水;
实验思考:
(1)因为氧气约占空气总体积的五分之一,当试管中的氧气被消耗完后,进入试管内的水的体积约占试管体积的五分之一.
故答案为:五分之一;
(2)该实验创新之处在于:可根据铁丝表面的铁锈和试管内空气体积减小两种现象来判断铁丝反应进行的情况.
故答案为:进入试管内的水的体积;
(3)在干燥的环境中可以防止菜刀生锈.
故答案为:除去水,防止生锈;
(4)铝比铁活泼,但铝难腐蚀,原因是铝易生成一层致密的氧化物保护膜,阻止铝进一步反应.
故答案为:铝易生成一层致密的氧化物保护膜,阻止铝进一步反应;
(5)铁锈的主要成分是氧化铁,铁在氧气中燃烧的化学方程式是3Fe+2O2
| ||
故答案为:氧化铁;3Fe+2O2
| ||
点评:解答本题要掌握铁生锈的条件,只有掌握了铁生锈的条件才能找出防止铁生锈的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



