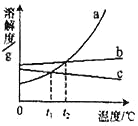
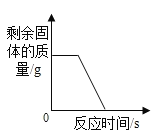
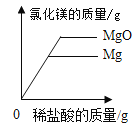
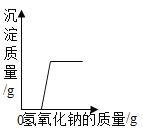
题目内容
【题目】为测定某铜锌合金中的铜的质量分数,某校化学兴趣小组用该合金与稀硫酸反应,进行了三次实验.所有的相关数据记录见下表(实验误差忽略不计);
第一次 | 第二次 | 第三次 | |
所取合金质量/g | 12.5 | 12.5 | 25 |
所用稀硫酸质量/g | 120 | 140 | 100 |
生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(1)计算该合金中铜的质量分数;_____
(2)求第三次实验所得溶液中溶质的质量分数._____
【答案】(1)48%(2)15.1%
【解析】
铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了,由此可知12.5g合金只能生成0.2g氢气;第三次所取的合金是前两次的2倍,但产生的气体和前两次相同只有0.2g,说明第三次反应中稀硫酸不足,由此可知25g合金中参加反应的锌的质量与12.5g合金中参加反应的锌的质量,从而可以结合氢气的质量计算出锌的质量和所得溶液中溶质的质量分数.
(1)比较三组数据可以知道,12.5g合金最多只能生成0.2g氢气,其中的锌完全参加反应
设12.5g铜锌合金中含有锌的质量为x,生成硫酸锌的质量为y
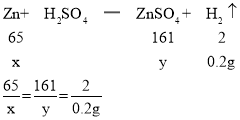
解得:x=6.5g; y=16.1g
铜合金中铜的质量分数为:![]() ;
;
铜锌合金中铜的质量分数为48%
(2)由第三次可知25g合金也生成0.2克氢气,说明100克稀硫酸最多消耗6.5g的锌,硫酸不足,根据(1)得出生成溶质硫酸锌的质量为16.1g;
所得溶液的质量为反应前加入合金和硫酸的质量之和减去生成氢气的质量;
则所得溶液中ZnSO4的质量分数:![]()
第三次实验所得溶液中溶质的质量分数15.1%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】罗筝依同学为探究Cu、Al、Ag的金属活动性顺序,做了如下两个实验。请分析实验,完成填空。

(1)试管②中发生了化学反应,现象明显,该反应的化学方程式是_____。
(2)通过实验探究,Cu、Al、Ag三种金属活动性由强到弱的顺序是_____。
(3)两支试管中的反应一段时间后,分别过滤,把滤液倒在烧杯中得到一种蓝色的混合液。黄一格同学由此认为试管①中Cu(NO)3溶液没有反应完,你认为他的结论正确吗?理由是_____。
同学们还想对混合液中的溶质成份进行探究:
(提出猜想)猜想一:_____;
猜想二:_____。
(设计实验)请选择其中一种猜想,并设计实验证明:
实验操作 | 实验现象 | 实验结果 |
取少量溶液于试管中,加入_____溶液 | _____。 | 猜想_____成立 |