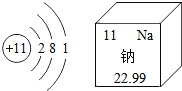
题目内容
【题目】为探究铜及其化合物的性质,进行如下实验:称取已部分被H2还原的氧化铜粉末(含Cu和CuO)7.2g置于烧杯中,向其中加入50g稀硫酸,充分反应后,再向烧杯中加入溶质质量分数为20%的NaOH溶液,加NaOH溶液的过程中,烧杯内固体物质的质量与加入NaOH溶液的质量关系如图所示。
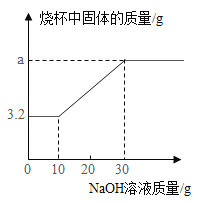
请计算:
(1)Cu和CuO的混合物中,Cu 元素和O元素的质量比。(写出计算过程,下同)
(2)实验所用稀硫酸中溶质的质量分数。
(3)a的值。
【答案】(1)8:1 (2)14.7% (3)8.1
【解析】
(1)稀硫酸与氧化铜反应生成硫酸铜和水,铜不与稀硫酸反应,故烧杯内剩余的3.2g固体物质即为铜的质量,氧化铜的质量为:7.2g-3.2g=4g。氧化铜中铜元素的质量为:4g×![]() ×100%=3.2g。那么Cu和CuO的混合物中,Cu 元素和O元素的质量比=(3.2g+3.2g):(7.2g-3.2g-3.2g)=8:1
×100%=3.2g。那么Cu和CuO的混合物中,Cu 元素和O元素的质量比=(3.2g+3.2g):(7.2g-3.2g-3.2g)=8:1
(2) 消耗氧化铜所用稀硫酸中溶质的质量为x。
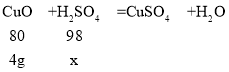
![]()
x=4.9g
消耗氢氧化钠所用稀硫酸中溶质的质量为y
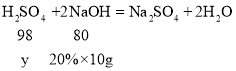
![]()
y=2.45g
实验所用稀硫酸中溶质的质量分数=![]()
(3)设反应生成氢氧化铜的质量为x。
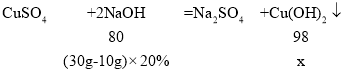
![]()
x=4.9g
故a的值=3.2+4.9=8.1

练习册系列答案
相关题目