题目内容
【题目】将一定质量的金属锌投入63.7g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示.试求 (计算结果精确到0.1%):
(1)完全反应后生成氢气的质量为_____g
(2)所用硫酸溶液中溶质的质量分数________?
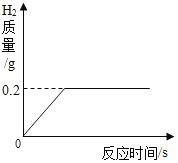
【答案】0.2g 15.4%
【解析】
由图看出生成的氢气的质量为0.2g,根据氢气的质量和对应的化学方程式求算稀硫酸中溶质的质量,进而求算其质量分数。
解:(1)由图可以看出生成的氢气的质量为0.2g;
(2)设稀硫酸中溶质的质量为x,

![]()
x=9.8g,
所用硫酸溶液中溶质的质量分数为![]() ×100%≈15.4%;
×100%≈15.4%;
答:(1)完全反应后生成氢气的质量为 0.2g;
(2)所用硫酸溶液中溶质的质量分数约为15.4%。

 阅读快车系列答案
阅读快车系列答案【题目】如表是甲、乙、丙三种物质的部分溶解度 (单位:g),请回答。
温度 (℃) | 10 | 20 | 30 | 40 | 50 | 60 |
甲 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
乙 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
丙 | 0.182 | 0.165 | 0.160 | 0.141 | 0.132 | 0.121 |
①10℃时,甲物质的溶解度是_____g;
②三种物质中溶解度受温度影响较大的是_____;
③物质在20℃的溶解性与其溶解度关系示意图如图所示,则丙物质的溶解性是_____;

④30℃时,三种物质的溶解度由大到小的顺序是_____;
⑤50℃时,三种物质饱和溶液的溶质质量分数最大的是_____。
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。