题目内容
(2013?包河区二模)巢湖被誉为合肥市的“璀璨明珠”,保护巢湖刻不容缓.“不让一滴污水流入巢湖”是我市的口号.对于学校化学实验室的实验废液必须经过处理后才能排放.某校化学实验后的废液中含NaCl、FeCl3、CuCl2,请你参与废液的处理.[提示:Fe(OH)3不溶于水]
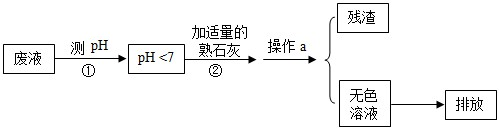
(1)测废液的pH<7,说明该溶液呈
(2)写出步骤②中任一反应的化学方程式:
(3)操作a的名称是
(4)若该废液直接排放到下水道会有什么危害:

(1)测废液的pH<7,说明该溶液呈
酸
酸
性.(2)写出步骤②中任一反应的化学方程式:
3Ca(OH)2 +2FeCl3=3CaCl2 +2Fe(OH)3↓
或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓
或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓
3Ca(OH)2 +2FeCl3=3CaCl2 +2Fe(OH)3↓
或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓
.或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓
(3)操作a的名称是
过滤
过滤
,其中玻璃棒起引流
引流
作用.(4)若该废液直接排放到下水道会有什么危害:
酸性废液腐蚀下水道,或CuCl2、FeCl3有毒性,污染河流、土壤等
酸性废液腐蚀下水道,或CuCl2、FeCl3有毒性,污染河流、土壤等
.分析:(1)根据溶液的pH判断溶液的酸碱性;
(2)根据氢氧化钙与氯化铁、氯化铜发生的复分解反应书写方程式;
(3)根据分离混合物后物质的状态分析操作及仪器的作用;
(4)根据酸对下水道的作用及铜离子、铁离子的危害分析.
(2)根据氢氧化钙与氯化铁、氯化铜发生的复分解反应书写方程式;
(3)根据分离混合物后物质的状态分析操作及仪器的作用;
(4)根据酸对下水道的作用及铜离子、铁离子的危害分析.
解答:解:(1)因为测废液的pH<7,说明该溶液呈酸性;
(2)氢氧化钙可以与氯化铁、氯化铜发生复分解反应产生氢氧化铁红褐色的沉淀、氢氧化铜蓝色的沉淀,并产生氯化钙,反应的方程式分别为:3Ca(OH)2 +2FeCl3=3CaCl2 +2Fe(OH)3↓或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓;
(3)经过a操作后得到固体残渣及溶液,故是过滤将氢氧化铁、氢氧化铜沉淀分离,过滤中玻璃棒的作用是引流;
(4)酸对下水道有腐蚀作用,氯化铜、氯化铁有毒,会产生污染;
故答案为:(1)酸;
(2)3Ca(OH)2 +2FeCl3=3CaCl2 +2Fe(OH)3↓
或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓;
(3)过滤; 引流;
(4)酸性废液腐蚀下水道,或CuCl2、FeCl3有毒性,污染河流、土壤等.
(2)氢氧化钙可以与氯化铁、氯化铜发生复分解反应产生氢氧化铁红褐色的沉淀、氢氧化铜蓝色的沉淀,并产生氯化钙,反应的方程式分别为:3Ca(OH)2 +2FeCl3=3CaCl2 +2Fe(OH)3↓或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓;
(3)经过a操作后得到固体残渣及溶液,故是过滤将氢氧化铁、氢氧化铜沉淀分离,过滤中玻璃棒的作用是引流;
(4)酸对下水道有腐蚀作用,氯化铜、氯化铁有毒,会产生污染;
故答案为:(1)酸;
(2)3Ca(OH)2 +2FeCl3=3CaCl2 +2Fe(OH)3↓
或Ca(OH)2 +CuCl2=CaCl2 +Cu(OH)2↓;
(3)过滤; 引流;
(4)酸性废液腐蚀下水道,或CuCl2、FeCl3有毒性,污染河流、土壤等.
点评:本考点属于物质的除杂或净化的探究,是中考的一个难点,也是学生经常出错的题型.解决本题可依据题目的信息结合已有的知识逐一分析.

练习册系列答案
相关题目