题目内容
【题目】“黄铜”是铜锌合金,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的。现取用20.0g某种黄铜投入100g某浓度的稀盐酸中恰好完全反应,反应后生成的溶液和残余固体总质量为119.8g,请计算:
(1)生成氢气的质量_____g
(2)这种黄铜中铜的质量分数为多少?(写出计算过程)_______
(3)原稀盐酸溶质的质量分数为多少?(写出计算过程)_______
【答案】0.2 67.5% 7.3%
【解析】
解:(1)根据质量守恒定律可知,生成氢气的质量为:20.0g+100.0g﹣119.8g=0.2g
(2)设黄铜中铜的质量分数为x。
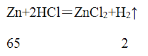
20.0g×(1﹣x) 0.2g
![]() =
=![]()
解得x=67.5%
(3)设原稀盐酸溶质的质量分数为y。
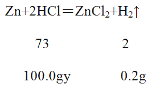
![]() =
=![]()
解得y=7.3%
答:(1)生成氢气的质量 0.2g;(2)这种黄铜中铜的质量分数为67.5%;(3)原稀盐酸溶质的质量分数为7.3%。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目