题目内容
某化学兴趣小组的同学设计了如下实验来验证二氧化碳气体的相关性质,实验步骤如下:
Ⅰ.取一个三通管(三个管口都未密封,与空气相通),在三通管的上部和下部各放一张湿润的蓝色石蕊试纸(湿润的蓝色石蕊试纸遇到酸性物质会变红)。然后将它与二氧化碳的发生装置连接。(如图1,整套装置的气密性良好)
Ⅱ.打开分液漏斗的活塞,使石灰石与稀盐酸接触,观察到相关现象后,停止实验。
Ⅲ.取下图1中的三通管,把贴有试纸B的那端放在酒精灯火焰上加热(如图2),
观察实验现象。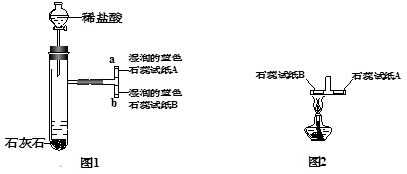
注:整个实验中不考虑反应过程中水分和HCl气体的挥发,且图1中产生的气流较缓慢
根据上述实验,回答下列问题:
(1)实验Ⅱ步骤中三通管内产生的实验现象是 __;由此说明二氧化碳气体具有 、 的性质。
(2)实验Ⅲ步骤中一定发生的化学反应方程式是 __;
(3)若不改变图1的实验装置,还要验证二氧化碳气体具有不能燃烧、也不能支持燃烧的性质,需要补充的实验是 __。
(4)取12g石灰石样品放入盛有105.4g稀盐酸溶液的烧杯中,恰好完全反应。有关实验数据如下表:(假设石灰石样品中杂质不与稀盐酸反应也不溶于水,且不考虑反应过程中水分和HCl气体的挥发)
| | 反应前 | 反应后 | |
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 150 g | 12 g | 157.6 g | |
②该石灰石样品中碳酸钙的质量分数为 __(结果精确到0.1%)。
(1)b处湿润的蓝色湿润试纸变红;二氧化碳密度大于空气,二氧化碳能与水反应
(2)H2CO3 H2O+CO2↑
H2O+CO2↑
(3)b处放一根燃着的木条
(4)①4.4g ②83.3%
解析试题分析:(1)由于二氧化碳的密度比空气大,故会从b导出,又二氧化碳能与水反应生成碳酸,而蓝色石蕊试纸遇酸变红,故可推知实验现象是湿润的蓝色石蕊试纸B变红色;由此说明二氧化碳气体具有密度比空气大、能与水反应生成碳酸的性质。
(2)由于碳酸不稳定,受热易分解生成二氧化碳和水,故反应的化学反应方程式为H2CO3 H2O+CO2↑。
H2O+CO2↑。
(3)由于二氧化碳气体不可燃、也不能支持燃烧,且二氧化碳的密度比空气大,故可取一根燃着的小木条放在b导管口,可观察到小木条熄灭。
(4)①石灰石中的主要成分碳酸钙与盐酸反应放出气体二氧化碳,恰好完全反应后所剩余物质的质量小于反应前各物质的质量和,根据质量守恒定律,质量的差即为反应所放出二氧化碳的质量,故反应中生成二氧化碳的质量=150g+12g-157.6g=4.4g;
②根据反应的化学方程式,利用生成的二氧化碳的质量,可计算出样品中碳酸钙的质量,再由碳酸钙的质量与样品质量比即可求出样品中碳酸钙的质量分数。
设恰好完全反应时参加反应碳酸的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
100:x=44:4.4g
解得x=10g
则该石灰石样品中碳酸钙的质量分数= ×100%≈83.3%
×100%≈83.3%
答:该石灰石样品中碳酸钙的质量分数为83.3%。
考点:常见气体的检验与除杂方法,有关溶质质量分数的简单计算,根据化学反应方程式的计算
点评:本题是一道综合实验、计算题,是课本实验的有效延伸,要求学生要具备扎实的基础知识和基本实验技能;关于方程式的计算,解题的关键是要会利用质量守恒定律,由反应前后质量的变化计算出反应放出二氧化碳的质量,然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.


 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.