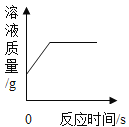
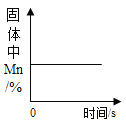
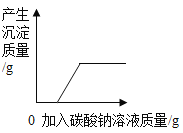
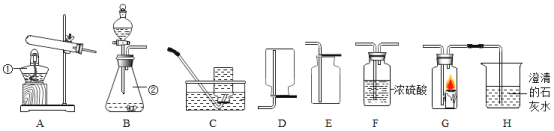
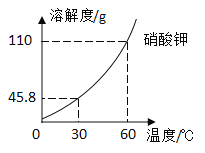
题目内容
【题目】下列实验方案,不能达到实验目的的是
选项 | A | B | C | D |
实验目的 | 探究石蜡中含碳元素 | 探究燃烧需要氧气 | 探究溶剂种类对溶解性的影响 | 探究铁生锈需要氧气和水 |
实验方案 |
|
|
|
|
A.AB.BC.CD.D
【答案】D
【解析】
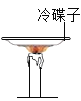
A、蜡烛火焰上方罩一冷碟子,碟子上有黑色的炭黑生成,根据质量守恒定律可知,石蜡中含碳元素,能达到实验目的,不符合题意;
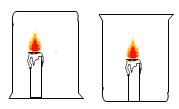
B、左边燃杯中的氧气随着蜡烛的燃烧,氧气越来越少,蜡烛很快熄灭,右边的蜡烛正常燃烧,说明燃烧需要氧气,能达到实验目的,不符合题意;
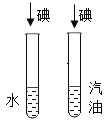
C、碘在汽油中几乎不能溶解,碘能在汽油中溶解,说明碘在不同的溶剂中的溶解性不同,能达到实验目的,不符合题意;
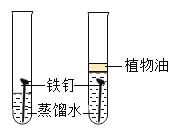
D、第一支试管中的铁钉能与氧气、水充分接触;第二支试管中的铁钉只能与水接触;一段时间后,第一支试管中的铁钉生锈;第二支试管的铁钉没有生锈;可用于探究铁生锈的条件之一是需要氧气,不能探究铁生锈需要水,不能达到实验目的,符合题意。故选D。

 名校课堂系列答案
名校课堂系列答案【题目】过氧化钠(![]() )是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中过氧化钠药品的成分进行了如下探究。
)是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中过氧化钠药品的成分进行了如下探究。
(查阅资料)①在点燃条件下, 钠在空气中燃烧生成纯度较高的![]()
②过氧化钠能和水以及二氧化碳发生如下化学反应:
![]() ;
;
![]() .
.
③金属钠遇水会发生剧烈反应生成![]()
Ⅰ.过氧化钠的制备:
研究小组设计如图装置制备过氧化钠。
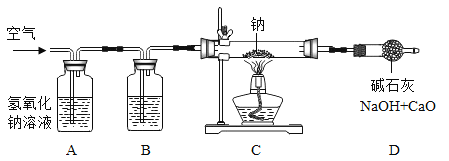
(1)装置B中的试剂是________。
(2)装置C中反应的化学方程式为________。
(3)装置D的作用是________。
Ⅱ.测定久置的过氧化钠样品的成分:
(定性检测)检测样品的成分
(4)请补充完成下列实验报告中的相关内容。
实验序号 | 实验步骤 | 实验现象 | 解释或结论 |
① | 取少量固体样品于试管中,加入适量的水 | 样品全部溶解,无气泡产生 | 样品中不含__; |
② | 取适量①中的溶液于试管中,加入过量的 | 有白色沉淀产生 | 化学方程式为_; |
③ | 待②充分静置后,向上层清液中滴入________; | _____; | 含有氢氧化钠 |
(定量检测)检测药品的组成。
(5)实验④:称取10g上述过氧化钠样品于试管中,加入足量的稀硫酸,将产生的气体全部鼓入到足量的澄清石灰水中,过滤、洗涤、干燥,得到碳酸钙固体5.00g。计算确定样品中氢氧化钠的质量分数_______(写出计算过程)
【题目】新能源页岩气,正在冲击传统能源体系。据报道,我国页岩气储量排名世界第一,合理开采将有利于改善我国的能源结构,川南页岩气田分布在泸州等地。页岩气是藏身于地下3000多米的页岩层裂缝中的天然气,在此高压环境中,还有部分溶解于裂缝中存在的少量石油里。目前,开采页岩气时从地表钻井到页岩层,向地下压入大量水和沙,使页岩气所在的地层产生缝隙,因压强降低,页岩气将从其藏匿处逸岀。这些水和沙将被抽回地面,形成返排液。
回答下列问题:
(1)页岩气中主要成分的化学式是_____,溶解在石油中的页岩气逸出的原因_____。
(2)页岩气中还可能含有乙烷(C2H6),写出乙烷完全燃烧的化学方程式_____。
(3)返排液是油、水溶液和沙组成的混合物。从返排液中分离出沙的实验操作名称是____;下表是某返排液中水溶液的主要成分及其含量,质量分数最高的金属离子是____,这些离子的含量远高于自然水。
离子 | K+ | Ca2+ | Mg2+ | HCO | Cl- |
含量(mg/L) | 310 | 491 | 129 | 470 | 26.1 |
(4)结合上文分析简答:开采时可能产生的主要环保问题是___(写一点),你的解决建议是_____。
【题目】某密闭容器中有X、O2和NO三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表.根据表中信息,判断下列说法正确的是
物质 | X | O2 | NO | H2O |
反应前质量/g | 17 | 70 | 1 | 0 |
反应后质量/g | 0 | 待测 | 31 | 27 |
A.该反应为置换反应
B.X的化学式可能是NH3
C.表中“待测”值为36
D.反应生成的NO和H2O的个数比为3∶2