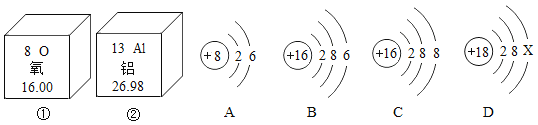
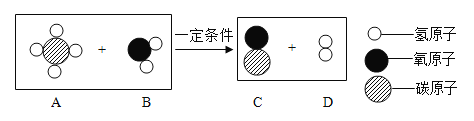
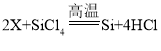题目内容
【题目】氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程:
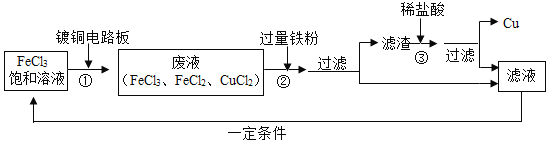
请回答下列问题:
(1)步骤②中发生了两个反应:![]() 和 ___。
和 ___。
(2)滤渣的成份有_____。
(3)该流程中可以循环、回收利用的物质是:______。
【答案】![]() Fe 、Cu FeCl3、Cu或FeCl2、Cu
Fe 、Cu FeCl3、Cu或FeCl2、Cu
【解析】
(1)过量的铁粉与氯化铜发生置换反应,得到金属铜和氯化亚铁,反应的化学方程为:Fe+CuCl2=FeCl2+Cu;同时,铁粉与剩余的氯化铁溶液反应,把混合溶液全部转化为纯净的氯化亚铁溶液;
(2)由于加入过量的铁粉,所以滤渣中不但有置换出来的铜,还有未反应完的铁;
(3)得到的纯净氯化亚铁溶液经过处理后可形成氯化铁溶液,再用来处理镀铜的电路板,循环利用;过程中把镀铜电路板上的铜回收再利用,可循环利用的物质为:FeCl3、Cu或FeCl2、Cu。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】中央电视台举办的“3.15”晚会,曝出某品牌金饰品掺假事件,引起同学们的好奇。某化学兴趣小组在老师的帮助下,对几种常见金属饰品所含的金属进行了相关的探究活动。
(提出问题)
(1)怎样鉴别真假黄金?
(2)怎样确定钯的金属活动性?
(查阅资料)
(1)假黄金通常是黄铜(Cu﹣Zn合金);
(2)钯(Pd)呈银白色,有金属光泽,可用作饰品。
(实验药品)钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
(实验探究)
(1)鉴别黄金样品的真假取黄金样品于试管中,滴加稀盐酸后,观察到黄金样品表面有气泡产生,该气体是_____,写出该反应的化学方程式______,说明此样品为______(选填“真”或“假”)黄金。
(2)探究钯的金属活动性依据生活经验,同学们猜想钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
实验步骤 | 实验现象 | 实验结论 |
把钯浸入硝酸银溶液中 | _____。 | 钯的活动性比银弱 |
把铂浸入氯化钯溶液中 | 无明显现象 | 钯的活动性比铂_____ |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为________________。
(废液处理)
(1)转化成沉淀:小组同学将所有液体倒入废液缸中,出现氯化银的白色沉淀,写出产生该沉淀的化学方程式_______________________。
(2)通过科学合理的方法进一步回收金属钯。