题目内容
某校化学兴趣小组在老师指导下探究孔雀石(一种铜矿石)的组成元素.他们取50克孔雀石粉末,在密闭容器中加热,观察到孔雀石分解过程中有水和能使澄清石灰水变浑浊的气体产生,绿色的孔雀石逐渐变为黑色粉末(假设:孔雀石中的杂质不反应,生成的二氧化碳全部被石灰水吸收).在此过程中他们测定了五次,相关数据如下表:| 测定次数 | 生成沉淀的质量(g) | 生成水的质量(g) |
| 1 | 5 | 0.9 |
| 2 | 10 | 1.8 |
| 3 | X | 2.7 |
| 4 | 20 | 3.6 |
| 5 | 20 | 3.6 |
请分析数据,回答下列问题:
(1)组成孔雀石的元素有
(2)表中“X”的值为
(3)实验最终生成二氧化碳的质量是多少克(写出计算过程)?
分析:从题目中我们可以看出所发生的反应是:①碱式碳酸铜分解产生的②碱式碳酸铜分解产生的二氧化碳与石灰水的反应:实验最终生成二氧化碳的质量,分析表格中所给数据,我们可以看出沉淀的质量是以5g为单位递增的,所以第三次的测定数据应该是15g,到第四次测定时是20g沉淀,第五次仍然是20g说明第四次测定时碱式碳酸铜已经分解完毕,同时二氧化碳与石灰水的反应也已经完成.那么我们就可以根据第四次所测得的数据进行求算了.
解答:解:(1)根据物质的组成元素,我们从碱式碳酸铜的化学式中可以得到它的组成为:Cu、C、O、H
(2)分析表格中所给数据,我们可以看出沉淀的质量是以5g为单位递增的,所以第三次的测定数据应该是15g,故答案应为:15
(3)解:经分析表中数据可知,在第四次测定时碱式碳酸铜已分解完毕此时产生沉淀的质量为20g.
设实验最终生成二氧化碳的质量为x,则:
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
X 20g
=
解得:x=8.8g
答:实验最终生成二氧化碳的质量是8.8g.
(2)分析表格中所给数据,我们可以看出沉淀的质量是以5g为单位递增的,所以第三次的测定数据应该是15g,故答案应为:15
(3)解:经分析表中数据可知,在第四次测定时碱式碳酸铜已分解完毕此时产生沉淀的质量为20g.
设实验最终生成二氧化碳的质量为x,则:
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
X 20g
| 44 |
| x |
| 100 |
| 20g |
解得:x=8.8g
答:实验最终生成二氧化碳的质量是8.8g.
点评:解这类题的关键是根据题意写出发生反应的化学方程式,然后再根据题意来分析出已知量、未知量来进行解答.本题也可以根据碱式碳酸铜分解的化学方程式,以水的质量来进行求算.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目



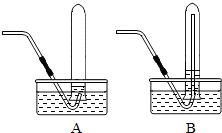 “化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水分解因素”的实验.请你帮助回答下列问题.
“化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水分解因素”的实验.请你帮助回答下列问题.