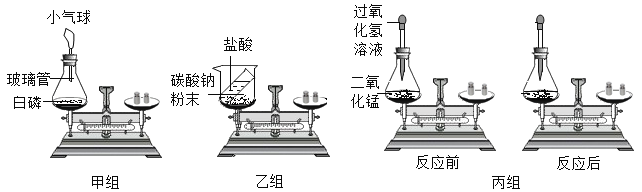
题目内容
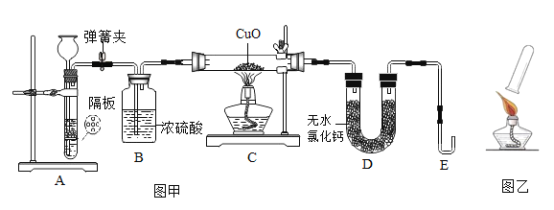
【题目】某课外小组利用H2 还原CuO 粉末的实验测定水的组成,图甲是测定装置的示意图。
(设计实验步骤)
①连接好装置,并检查气密性
②装入药品,打开弹簧夹,通入一段时间氢气后关闭弹簧夹
③分别称量装置C、D 的质量
④再次打开弹簧夹,通入氢气后,加热装置C
⑤待C 中固体全部变为红色后,停止加热
⑥继续通入氢气,待装置C 恢复至室温后,关闭弹簧夹
⑦再次分别称量装置C、D 的质量
(完善实验设计)经过讨论同学们认为,为了提高实验的安全性,步骤④加热装置 C 前, 应在 E 导管口收集一试管气体后,进行如图乙所示操作,若操作过程中听到尖锐爆鸣声, 则反应的化学方程式是_____。
(进行实验)该小组的同学按上述步骤进行实验,并进行了实验数据(C 中玻璃管质量为60.0g)
装置C 的质量/g | 装置D 的质量/g | |
反应前 | 68.0 | 158.2 |
反应后 | 67.2 | 159.1 |
(1)小组同学利用锌粒和稀硫酸反应制氢气,请写出反应的化学方程式_____。在锌与稀硫酸反应的过程中,若夹紧弹簧夹,则A 中反应停止,其原理是_____。
(2)步骤⑥的目的是_____。
(数据处理)
(1)根据上表中数据,水中氢、氧元素的质量比等于_____(使用原始数据列式,不用计算出结果)。
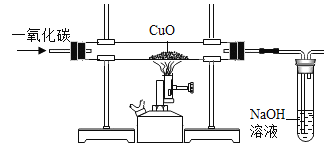
(拓展探究)该小组同学参考上述实验原理,模仿实验步骤,设计了如图装置(假设氢氧化钠溶液能完全吸收二氧化碳),打算测定二氧化碳中碳、氧元素的质量比。但测出的碳、氧元素的质量比总是小于 3:8,请分析可能的原因_____。
【答案】2H2+O2 2H2O Zn+H2SO4=ZnSO4+H2↑ 关闭弹簧夹后,试管内生成气体,气压增大,将液体压回长颈漏斗,固液分离,反应停止 让生成的水蒸气全部进入D装置,使其被充分吸收减少误差;或防止空气进入C中,使铜又被氧化造成误差;或答防止空气中的水蒸气被吸入D中造成误差 [(159.1-158.2)-(68.0-67.2)]:(68.0-67.2) 气体经过氢氧化钠溶液带出水蒸气,使测得的二氧化碳质量偏小
2H2O Zn+H2SO4=ZnSO4+H2↑ 关闭弹簧夹后,试管内生成气体,气压增大,将液体压回长颈漏斗,固液分离,反应停止 让生成的水蒸气全部进入D装置,使其被充分吸收减少误差;或防止空气进入C中,使铜又被氧化造成误差;或答防止空气中的水蒸气被吸入D中造成误差 [(159.1-158.2)-(68.0-67.2)]:(68.0-67.2) 气体经过氢氧化钠溶液带出水蒸气,使测得的二氧化碳质量偏小
【解析】
[完善实验设计]
氢气在空气中燃烧生成水,反应的化学方程式是:2H2+O2 2H2O。故填:2H2+O2
2H2O。故填:2H2+O2 2H2O;
2H2O;
[进行实验]
(1)锌和稀硫酸反应生成氢气和硫酸锌;在锌与稀硫酸反应的过程中,若夹紧弹簧夹,则A 中反应停止,其原理是关闭弹簧夹后,试管内生成气体,气压增大,将液体压回长颈漏斗,固液分离,反应停止。故填:Zn+H2SO4=ZnSO4+H2↑;关闭弹簧夹后,试管内生成气体,气压增大,将液体压回长颈漏斗,固液分离,反应停止;
(2)步骤⑥的目的是让生成的水蒸气全部进入D装置,使其被充分吸收减少误差。故填:让生成的水蒸气全部进入D装置,使其被充分吸收减少误差。
[数据处理]
(1)根据上表中数据,水中氢、氧元素的质量比等于[(159.1-158.2)-(68.0-67.2)]:(68.0-67.2),故填:[(159.1-158.2)-(68.0-67.2)]:(68.0-67.2);
[拓展探究]该小组同学参考上述实验原理,模仿实验步骤,设计了如图装置(假设氢氧化钠溶液能完全吸收二氧化碳),打算测定二氧化碳中碳、氧元素的质量比。但测出的碳、氧元素的质量比总是小于 3:8,请分析可能的原因是:气体经过氢氧化钠溶液带出水蒸气,使测得的二氧化碳质量偏小。
故填:气体经过氢氧化钠溶液带出水蒸气,使测得的二氧化碳质量偏小。

【题目】甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如表所示:下列判断正确的是( )
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
A.表中a的值为2.6
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若增加氧气量,则生成物的种类可能减少