题目内容
【题目】甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如表所示:下列判断正确的是( )
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
A.表中a的值为2.6
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若增加氧气量,则生成物的种类可能减少
【答案】D
【解析】
A、参加反应的甲烷和氧气的质量为3.2g+11.2g=14.4g,生成物的质量为7.2g+4.4g+a=14.4g,故a=2.8g;故A错误;
B、X的质量在反应后增加,故X为生成物,故B错误;
C、3.2g甲烷中氢元素的质量为:3.2g×![]() ×100%=0.8g,则碳元素的质量为:3.2g-0.8g=2.4g;7.2g水中氢元素的质量为:7.2g×
×100%=0.8g,则碳元素的质量为:3.2g-0.8g=2.4g;7.2g水中氢元素的质量为:7.2g×![]() ×100%=0.8g,
×100%=0.8g,
故X中不含有氢元素,故C错误;
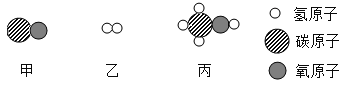
D、由C中计算可知,3.2g甲烷中碳元素的质量为2.4g;4.4g二氧化碳中碳元素的质量为:4.4g×![]() ×100%=1.2g;故X中应含有2.4g-1.2g=1.2g碳元素,又因为X的质量为2.8g,故X中应含有1.6g氧元素,故X为一氧化碳,是甲烷不充分燃烧生成的,增加氧气量,就不会生成一氧化碳,则生成物的种类可能减少,故D正确。
×100%=1.2g;故X中应含有2.4g-1.2g=1.2g碳元素,又因为X的质量为2.8g,故X中应含有1.6g氧元素,故X为一氧化碳,是甲烷不充分燃烧生成的,增加氧气量,就不会生成一氧化碳,则生成物的种类可能减少,故D正确。
故选:D。

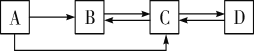
【题目】概念之间存在并列、交叉和包含等3中关系。符合如图所示关系的一组概念是( )
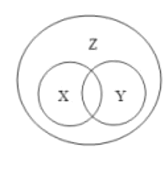
序号 | X | Y | Z |
A | 氧化物 | 纯净物 | 物质 |
B | 化合反应 | 氧化反应 | 化学反应 |
C | 单质 | 化合物 | 纯净物 |
D | 饱和溶液 | 不饱和溶液 | 溶液 |
A.AB.BC.CD.D
【题目】为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都完全正确的是( )
物 质 | 选用试剂(过量) | 操作方法 | |
A | 铜粉(CuO) | 稀盐酸 | 加入稀盐酸充分反应后过滤、洗涤 |
B | CaO(CaCO3) | 水 | 加水溶解、过滤 |
C | 铁粉 (锌粉) | FeSO4 | 加FeSO4溶液充分反应后过滤、洗涤、干燥 |
D | FeSO4溶液(CuSO4) | 锌粉 | 加入锌粉充分反应后过滤 |
A.AB.BC.CD.D
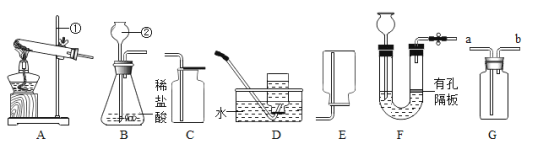
【题目】某课外小组利用H2 还原CuO 粉末的实验测定水的组成,图甲是测定装置的示意图。
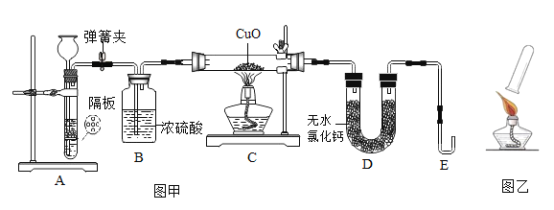
(设计实验步骤)
①连接好装置,并检查气密性
②装入药品,打开弹簧夹,通入一段时间氢气后关闭弹簧夹
③分别称量装置C、D 的质量
④再次打开弹簧夹,通入氢气后,加热装置C
⑤待C 中固体全部变为红色后,停止加热
⑥继续通入氢气,待装置C 恢复至室温后,关闭弹簧夹
⑦再次分别称量装置C、D 的质量
(完善实验设计)经过讨论同学们认为,为了提高实验的安全性,步骤④加热装置 C 前, 应在 E 导管口收集一试管气体后,进行如图乙所示操作,若操作过程中听到尖锐爆鸣声, 则反应的化学方程式是_____。
(进行实验)该小组的同学按上述步骤进行实验,并进行了实验数据(C 中玻璃管质量为60.0g)
装置C 的质量/g | 装置D 的质量/g | |
反应前 | 68.0 | 158.2 |
反应后 | 67.2 | 159.1 |
(1)小组同学利用锌粒和稀硫酸反应制氢气,请写出反应的化学方程式_____。在锌与稀硫酸反应的过程中,若夹紧弹簧夹,则A 中反应停止,其原理是_____。
(2)步骤⑥的目的是_____。
(数据处理)
(1)根据上表中数据,水中氢、氧元素的质量比等于_____(使用原始数据列式,不用计算出结果)。
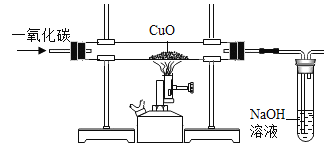
(拓展探究)该小组同学参考上述实验原理,模仿实验步骤,设计了如图装置(假设氢氧化钠溶液能完全吸收二氧化碳),打算测定二氧化碳中碳、氧元素的质量比。但测出的碳、氧元素的质量比总是小于 3:8,请分析可能的原因_____。