题目内容
【题目】豆腐乳富含蛋白质、碳水化合物、不饱和脂肪酸、矿物质(钙、磷、铁)、人体不能合成的8种必需氨基酸、胡萝卜素及多种维生素等,具有健脾、润燥、除湿等功效,因其营养价值极高而素有“东方奶酪”之称。
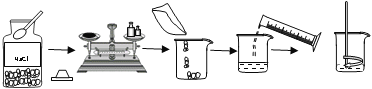
制作腐乳的工艺流程是:豆腐切块→长出毛霉→加盐腌制(析出水分,使豆腐块变硬,同时抑制微生物的生长,避免豆腐块腐败变质)→加卤汤装瓶(形成独特风味)→密封腌制发酵。腐乳发酵分为前酵与后酵。前酵是培菌累积酶系的过程,一般为36~48 h。后酵是酶系作用于腐乳坯体的过程,耗时较长,一般为3至6个月。
因菌种、配料、腌制时间和后熟时间等的不同,腐乳按色泽风味分为红腐乳、白腐乳、青腐乳(“臭豆腐”)、酱腐乳等。红腐乳的红色主要是红曲菌产生的红色色素;白腐乳的乳黄色是黄酮类物质,在酶作用下缓慢氧化产生;青腐乳的淡青色是氨基酸分解生成的硫与金属离子结合产生的。
腐乳发酵过程中食盐含量对化学组分的影响如下图所示。

腐乳中食盐和嘌呤含量普遍较高,高血压、心血管病、痛风、肾病患者及消化道溃疡患者,宜少吃或不吃,以免加重病情。臭腐乳发酵后,容易被微生物污染,另外臭腐乳豆腐坯中的蛋白质会氧化产生含硫的化合物,如果吃太多的臭腐乳,影响身体健康。
随着人民生活水平的提高和国民经济的发展,人们对腐乳的质量要求越来越高。
依据文章内容,回答下列问题。
(1)豆腐乳被称为“东方奶酪”,是因为__________。
(2)下列制作腐乳的工艺流程中,属于物理变化的是__________。
A.豆腐切块 B.长出毛霉 C.加汤装瓶 D.密封发酵
(3)臭腐乳中的含硫化合物是由__________转化生成的。
(4)腐乳制作过程中,不应加入过多的食盐,其理由是__________。
(5)下列关于腐乳的说法中,合理的是__________。
A.腐乳含有丰富的蛋白质 B.在腐乳发酵过程中,pH逐渐减小
C.高血压、心血管病人应少吃或不吃腐乳 D.白腐乳的颜色,是通过氧化反应形成的
【答案】 营养价值高 AC 蛋白质 NaCl含量高会减少蛋白质含量 ACD
【解析】本题通过腐乳制作的原理和过程,考查了获得信息,处理信息,利用信息的能力,解题的关键是认真阅读,获取有用信息。
(1)豆腐乳富含蛋白质、碳水化合物、不饱和脂肪酸、矿物质(钙、磷、铁)、人体不能合成的8种必需氨基酸、胡萝卜素及多种维生素等,具有健脾、润燥、除湿等功效。豆腐乳被称为“东方奶酪”,原因是它营养价值高;
(2)A、豆腐切块,只是豆腐的形状发生了改变,没有新物质生成,属于物理变化;B、长出毛霉的过程中分解食物中的营养素,有新物质生成,属于化学变化;C、加汤装瓶过程中没有新物质生成,属于物理变化;D、密封发酵过程中蛋白质分解成营养价值高的氨基酸和一些风味物质,有新物质生成,属于化学变化;故选AC;
(3)根据“臭腐乳豆腐坯中的蛋白质会氧化产生含硫的化合物”可知,臭腐乳中的含硫化合物是由蛋白质转化来的;
(4)根据图1、2可知,腐乳制作过程中,不应加入过多的食盐,其理由是NaCl含量高会减少蛋白质含量;
(5)A、腐乳含有丰富的蛋白质,正确;B、根据图示可知,在腐乳发酵过程中,pH先变大后变小,错误;C、腐乳中食盐和嘌呤含量普遍较高,高血压、心血管病人应少吃或不吃腐乳,以免加重病情,正确;D、白腐乳的乳黄色是黄酮类物质,在酶作用下缓慢氧化产生。白腐乳的颜色,是通过氧化反应形成的,正确。故选ACD。

 寒假学与练系列答案
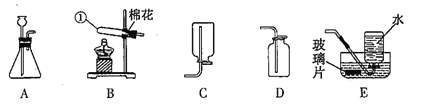
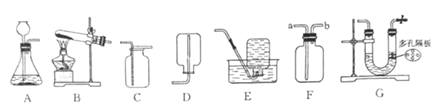
寒假学与练系列答案【题目】实验是学习化学的重要手段,请结合下图所示实验回答相应问题。
|
|
|
实验一 | 实验二 | 实验三 |
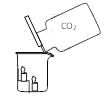
(1)实验一中观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是_________________________。
(2)实验二是配制50g质量分数为6%的氯化钠溶液的实验,应称取NaCI的质量为____g,某同学在量取液体体积时俯视读数,这样会使所配溶液的质量分数 ___6%(填“大于”,“等于”或“小于”)。
(3)实验三是电解水的实验,该实验说明水是由______________组成的。
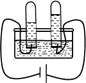
【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某兴趣小组同学在课外进行了有关过氧化氢分解反应的再探究。
(查阅资料)催化剂指的是能够改变化学反应的速率而自身的质量和化学性质在化学反应前后均不发生变化的物质。
(探究一)影响过氧化氢分解速率的因素有哪些?
兴趣小组同学做了四个实验,实验数据如下表:
实验 序号 | H2O2溶液的溶质质量分数% | H2O2溶液的体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应 时间 |
① | 5 | 1 | 20 | 0.1 | 4 | 16 s |
② | 15 | 1 | 20 | 0.1 | 4 | 6 s |
③ | 30 | 5 | 35 | 0 | 4 | 98 min |
④ | 30 | 5 | 55 | 0 | 4 | 20min |
(1)过氧化氢分解速率与温度的关系是__________。
(2)能说明过氧化氢的分解速率与其质量分数有关的实验是__________(填实验序号)。
(探究二)MnO2的聚集状态是否影响其催化效果?
将质量相同但聚状态不同的MnO2分别加入到5mL5%的H2O2溶液中,测试结果如下:
MnO2的状态 | 操作情况 | 观察结果 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 |
块状 | 反应较慢,火星红亮但木条未复燃 |
由上述实验得到的结论是__________。
(探究三)其他金属氧化物能否起到类似MnO2的催化作用?
兴趣小组同学用天平称量0.2gCuO,用量筒量取5mL5%的H2O2溶液,进行如下图所示实验(①~⑦代表实验操作步骤)。

(1)小组同学通过上述实验得出结论:CuO可作过氧化氢分解的催化剂,支持该结论的实验证据是__________。
(2)过氧化氢能被CuO催化分解放出氧气的化学反应方程式为__________。
(3)欲比较不同催化剂CuO和MnO2对H2O2分解速率的影响,实验时需要控制的变量有__________。
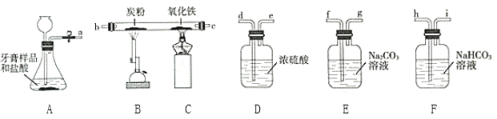
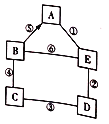
【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验:

(1)试管A中的现象是 ,反应后试管B中一定有的阳离子是 (写离子符号)。
(2)试管C中反应的化学方程式为 。小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。过滤,得到白色沉淀和无色滤液。
小芳同学欲探究无色滤液中的溶质成分:
小芳同学分析得出无色滤液中一定不含HCl,理由是 。
【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl 、CaCl2和Na2CO3;④NaCl和Na2CO3。
小明认为猜想 一定不正确。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想 成立 |
②取少量滤液于试管中,滴加少量 | 有气泡产生 |