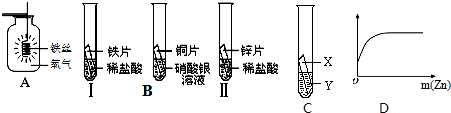
题目内容
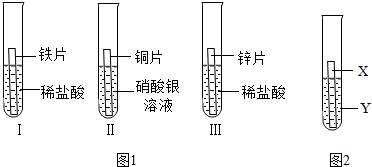
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如图所示三个实验:(所用金属的形状与大小及稀盐酸的用量均相同)
(1)实验①中的反应化学方程式为_________.
(2)一段时间后,根据实验②观察到现象,可得出结论是_________.
(3)乙同学认为上述三个实验不能够得出四种金属的活动性顺序,还需要利用如图所示的实验装置,补充实验来实现探究目的.
(2)一段时间后,根据实验②观察到现象,可得出结论是_________.
(3)乙同学认为上述三个实验不能够得出四种金属的活动性顺序,还需要利用如图所示的实验装置,补充实验来实现探究目的.
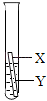
乙同学实验用的金属X是_________,溶液Y是_________;(其他合理答案也可)(要求写出化学式).
(4)丙同学用100g上述实验的盐酸分别跟足量的铁和锌反应,并绘制了生成氢气的质量(m/g)与时间(t/s)的关系图(如图所示).试回答:
(4)丙同学用100g上述实验的盐酸分别跟足量的铁和锌反应,并绘制了生成氢气的质量(m/g)与时间(t/s)的关系图(如图所示).试回答:
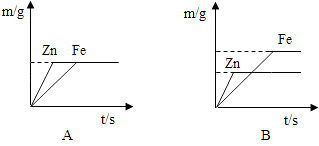
①判断A、B两图能表示丙同学所做实验结果是 _________ 图.
②若用100g盐酸与足量的铁反应能生成0.4g氢气.那么:
(Ⅰ)该盐酸溶液含HCl质量是 _________ .
(Ⅱ)该盐酸中溶质的质量分数是 _________ .
②若用100g盐酸与足量的铁反应能生成0.4g氢气.那么:
(Ⅰ)该盐酸溶液含HCl质量是 _________ .
(Ⅱ)该盐酸中溶质的质量分数是 _________ .
(1)Fe+2HCl=FeCl2+H2↑
(2)铜的活泼性大于银
(3)Cu,HCl(答案合理即可)
(4)①A
②(Ⅰ)设反应掉的HCl的质量为X
Fe+2HCl=FeCl2+H2↑
73 2
x 0.4g
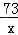 =
=
X=14.6g
(Ⅱ) ×100%=14.6%
×100%=14.6%
(2)铜的活泼性大于银
(3)Cu,HCl(答案合理即可)
(4)①A
②(Ⅰ)设反应掉的HCl的质量为X
Fe+2HCl=FeCl2+H2↑
73 2
x 0.4g
 =
=
X=14.6g
(Ⅱ)
 ×100%=14.6%
×100%=14.6%
练习册系列答案
相关题目
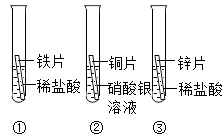
 43、在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:
43、在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验: 验的基础上,设计一个补充实验来实现探究目的.他两若按如图所示的实验探究时,你决定推荐:
验的基础上,设计一个补充实验来实现探究目的.他两若按如图所示的实验探究时,你决定推荐: 29、我们的日常生活离不开金属.
29、我们的日常生活离不开金属.
 ①一段时间后,可观察到实验Ⅱ的现象是
①一段时间后,可观察到实验Ⅱ的现象是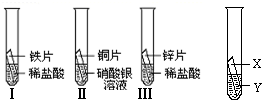 在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)