题目内容
 29、我们的日常生活离不开金属.
29、我们的日常生活离不开金属.(1)右图是金属的一个应用实例,请说出利用了金属的什么物理性质?
导电性
(答出一点即可)延展性
.(2)据有关资料报导,现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%-40%.铁生锈是铁与空气中的水蒸气、
氧气
等发生化学反应的过程.(3)在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
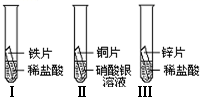
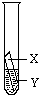 ①一段时间后,可观察到实验Ⅱ的现象是
①一段时间后,可观察到实验Ⅱ的现象是铜片表面有银白色固体附着
;反应的化学方程式是Cu+2AgNO3═Cu(NO3)2+2Ag
②小组中的甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁的金属活动性强弱.你认为他依据的实验现象是
实验Ⅲ中产生气体的速度比实验Ⅰ的快
.③乙和丙两位同学认为上述三个实验不能够得出四种金属的活动性顺序,原因是
无法比较Fe和Cu的活动性
;并在上述实验的基础上,补充了一个实验(右图所示),实现了探究目的.他们的实验:X是金属
Fe
,Y是CuSO4
溶液(写出化学式).分析:(1)根据金属具有良好的导热性、导电性、延展性等方面的性质;
(2)铁生锈的条件进行判断;
(3)金属活动性的探究要通过彼此之间的相互反应等来进行验证.
(2)铁生锈的条件进行判断;
(3)金属活动性的探究要通过彼此之间的相互反应等来进行验证.
解答:解:(1)金属可以制作电线说明金属具有良好的导电性、延展性;
(2)根据铁生锈的条件是,铁在与氧气和水同时接触时容易生成铁锈;
(3)①实验Ⅱ中,铜的活动性比银强,能够从硝酸银溶液中置换出银,红色铜片表面有银白色固体析出,无色溶液变蓝色,其反应化学方程式为:Cu+2AgNO3═Cu( NO3)2+2Ag;
②Ⅰ中铁和稀盐酸能够反应,Ⅲ中锌片也能够和稀盐酸反应,这两个同时都反应,它们的形状与大小及稀盐酸的质量分数和用量均相同的条件下,实验Ⅲ中产生气体的速度比实验Ⅰ的快,锌比铁反应剧烈,这说明了锌比铁更活泼;
③实验Ⅰ和实验Ⅲ能证明锌比铁活动性强,实验Ⅰ实验Ⅱ无法比较Fe和Cu的活动性;在补充实验中,可用铁置换硫酸铜中的铜,可以证明铁比铜活泼,故可判断出该三种金属的活动性由强到弱的顺序为锌、铁、铜,它们的活动性都比银强;
故答案为:
(1)导电性、延展性;
(2)氧气;
(3)①铜片表面有银白色固体附着;Cu+2AgNO3═Cu(NO3)2+2Ag;
②实验Ⅲ中产生气体的速度比实验Ⅰ的快;
③无法比较Fe和Cu的活动性;Fe;CuSO4.
(2)根据铁生锈的条件是,铁在与氧气和水同时接触时容易生成铁锈;
(3)①实验Ⅱ中,铜的活动性比银强,能够从硝酸银溶液中置换出银,红色铜片表面有银白色固体析出,无色溶液变蓝色,其反应化学方程式为:Cu+2AgNO3═Cu( NO3)2+2Ag;
②Ⅰ中铁和稀盐酸能够反应,Ⅲ中锌片也能够和稀盐酸反应,这两个同时都反应,它们的形状与大小及稀盐酸的质量分数和用量均相同的条件下,实验Ⅲ中产生气体的速度比实验Ⅰ的快,锌比铁反应剧烈,这说明了锌比铁更活泼;
③实验Ⅰ和实验Ⅲ能证明锌比铁活动性强,实验Ⅰ实验Ⅱ无法比较Fe和Cu的活动性;在补充实验中,可用铁置换硫酸铜中的铜,可以证明铁比铜活泼,故可判断出该三种金属的活动性由强到弱的顺序为锌、铁、铜,它们的活动性都比银强;
故答案为:
(1)导电性、延展性;
(2)氧气;
(3)①铜片表面有银白色固体附着;Cu+2AgNO3═Cu(NO3)2+2Ag;
②实验Ⅲ中产生气体的速度比实验Ⅰ的快;
③无法比较Fe和Cu的活动性;Fe;CuSO4.
点评:考查金属的性质及其应用,通过实验探究金属的活动性顺序,掌握铁生锈的原理及正确书写化学方程式的能力,培养学生的探究能力、实验分析能力、综合解决问题的能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目