题目内容
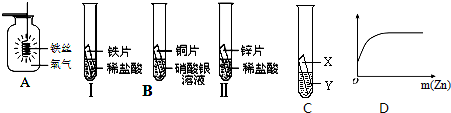
 43、在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:
43、在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
(1)实验①中的反应化学方程式为
Fe+2HCl=FeCl2+H2↑
;(2)一段时间后,可观察到实验②的现象和获得的结论是
铜片上有黑色物质析出,铜的活泼性大于银
.(3)若小组中的甲同学认为,通过实验①和③可比较出锌和铁的金属活动性强弱,你认为他依据的实验现象是
锌产生气体比铁的快
.(4)若乙和丙两位同学认为,上述三个实验不能够得出四种金属的活动性顺序时,请你帮助他们在上述实
 验的基础上,设计一个补充实验来实现探究目的.他两若按如图所示的实验探究时,你决定推荐:
验的基础上,设计一个补充实验来实现探究目的.他两若按如图所示的实验探究时,你决定推荐:乙同学:实验用的金属X是
Fe
,溶液Y是CuSO4
;丙同学:实验用的金属X是
Cu
,溶液Y是HCl
(要求写出化学式).分析:要探究金属的活动性顺序,就要选择相应的试剂,根据题目给出的探究图示和课堂上做的实验,同学们就可以回答出相应的实验现象,并能写出相应的化学方程式,要注意配平.有关图示中的实验设计是本题的一个难点,联系题意就知道必须要证明铁和铜的活动性顺序,本小题的开放性比较强,答案不唯一.
解答:解:(1)铁排在氢的前面,因此铁可以置换出酸中的氢原子,注意单质铁只能生成氯化亚铁.
故答案为:Fe+2HCl=FeCl2+H2↑
(2)铜排在银的前面,因此铜可以把银从它的盐溶液中置换出来,银的粉末是黑色.
故答案为:铜片上有黑色物质析出,铜的活泼性大于银
(3)通过实验可知①中产生的气泡慢而少;③中产生的气泡快而多.
故答案为:锌产生气体比铁的快
(4)通过题意可知:必须要证明铁和铜的活动性.方法是:只要把铁放入铜的盐溶液中;或把铜放入铁的盐溶液中;或把铜放入稀盐酸中;观察现象即可.
故答案为:乙:Fe CuSO4[或CuCl2、Cu(NO3)2]
丙:Cu HCl
故答案为:Fe+2HCl=FeCl2+H2↑
(2)铜排在银的前面,因此铜可以把银从它的盐溶液中置换出来,银的粉末是黑色.
故答案为:铜片上有黑色物质析出,铜的活泼性大于银
(3)通过实验可知①中产生的气泡慢而少;③中产生的气泡快而多.
故答案为:锌产生气体比铁的快
(4)通过题意可知:必须要证明铁和铜的活动性.方法是:只要把铁放入铜的盐溶液中;或把铜放入铁的盐溶液中;或把铜放入稀盐酸中;观察现象即可.
故答案为:乙:Fe CuSO4[或CuCl2、Cu(NO3)2]
丙:Cu HCl
点评:金属的活动性顺序是中考的重点内容之一,本题既考查了实验现象的描述、化学方程式的书写,又考查了学生的实验设计能力,综合性比较强.经常出现在选择题、填空题和实验题中,同学们要认真掌握.

练习册系列答案
相关题目
 29、我们的日常生活离不开金属.
29、我们的日常生活离不开金属.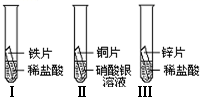
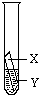 ①一段时间后,可观察到实验Ⅱ的现象是
①一段时间后,可观察到实验Ⅱ的现象是 在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)