题目内容
【题目】现有一包镁粉和氧化镁的混合物,为研究该混合物的组成,取6.8g混合物先加热完全反应后,再加入73g质量分数为20%的盐酸,恰好完全反应,混合物中镁粉与氧化镁的质量之比为( )
A. 3:2B. 3:8C. 8:27D. 9:25
【答案】D
【解析】
混合物加热后镁粉也变成了氧化镁,再加入73g质量分数为20%的盐酸,恰好与之完全反应,所以先根据盐酸求出氧化镁的总质量,然后再由原来镁粉和氧化镁的混合物质量6.8g和加热后得到的氧化镁总质量,用元素守恒求出混合物中镁粉与氧化镁的质量之比
解:设氧化铜质量为x
![]()
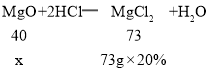
![]() ,
,
x=8g,
设镁单质质量为y,根据镁元素质量相等,则![]()
y=1.8g,
混合物中镁粉与氧化镁的质量之比为1.8g:(6.8g﹣1.8g)=9:25。
故选D。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】金属在生产和生活中应用广泛。请回答下列问题。
(1)生活中常用铁锅做饭,主要利用了铁的_____性。
(2)厨房中铁锅容易生锈,结合生活实际,写出一种防止铁锅生锈的具体方法_____。
(3)铝合金制造的飞机外壳,具有轻量化、能抗击强大气流的冲击、耐受水雾和雨雪侵蚀等特点。这是利用了铝合金的_____、_____等优点(写出两条即可)。
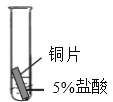
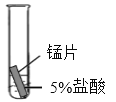
(4)某研究小组为探究铁、铜、锰(Mn)的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用 5%的盐酸体积相同)。
(实验记录与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 无明显现象 | 立即产生气泡,速率较快 |
实验结论 | 铁、铜、锰的金属活动性顺序由强到弱为______>______>_____ | ||
写出实验一试管中铁和盐酸发生反应的化学方程式_________________________________________________________________。