题目内容
【题目】金属在生产和生活中应用广泛。请回答下列问题。
(1)生活中常用铁锅做饭,主要利用了铁的_____性。
(2)厨房中铁锅容易生锈,结合生活实际,写出一种防止铁锅生锈的具体方法_____。
(3)铝合金制造的飞机外壳,具有轻量化、能抗击强大气流的冲击、耐受水雾和雨雪侵蚀等特点。这是利用了铝合金的_____、_____等优点(写出两条即可)。
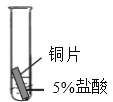
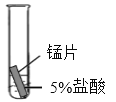
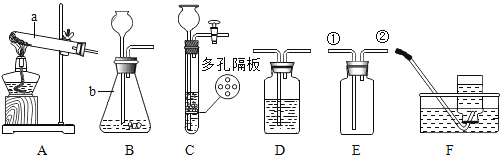
(4)某研究小组为探究铁、铜、锰(Mn)的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用 5%的盐酸体积相同)。
(实验记录与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 无明显现象 | 立即产生气泡,速率较快 |
实验结论 | 铁、铜、锰的金属活动性顺序由强到弱为______>______>_____ | ||
写出实验一试管中铁和盐酸发生反应的化学方程式_________________________________________________________________。
【答案】导热 保持铁锅干燥 耐腐蚀 质量轻 锰 铁 铜 ![]()
【解析】
铁生锈的主要条件是铁与潮湿的空气直接接触,防止钢铁生锈的具体方法有在铁制品表面涂矿物性油,油漆或烧制搪瓷。在金属活动顺序表中,一般位置越后的金属,金属性越弱,原子的还原性越弱;位置越前的金属,金属性越强,原子的还原性越强。
(1)生活中常用铁锅做饭,主要利用了铁的导热性。
(2)厨房中铁锅容易生锈,结合生活实际,防止铁锅生锈的具体方法保持铁锅干燥。
(3)铝合金制造的飞机外壳,具有轻量化、能抗击强大气流的冲击、耐受水雾和雨雪侵蚀等特点。这是利用了铝合金的耐腐蚀、质量轻等优点。
(4)铁、铜、锰和盐酸反应,锰立即产生气泡,速率较快,铁立即产生气泡,速率较慢,则锰比铁强,铜无明显现象,故金属活动性顺序由强到弱为锰>铁>铜,试管中铁和盐酸发生反应生成氯化铁和氢气,化学方程式![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】(9分)张华同学对酸、碱、盐的知识进行了以下的梳理。
(1)填写下表空格中的化学式。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
KCl | CaCl2 | NaCl | MgCl2 | ZnCl2 | FeCl2 |
思考:根据以上盐中的金属元素的排列,可以得出他是依据______________顺序归纳整理的。
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图。请你在右边的圆圈中填入适当的化学式或离子符号:

(3)张华同学发现酸、碱、盐之间的反应都有盐类物质生成。请写出一个能生成MgCl2的复分解反应的化学方程式:__________________________。
(4)我们知道溶液酸碱度pH可显示的溶液的酸碱性;酸溶液pH<7,溶液显酸性;碱溶液pH>7,溶液显碱性.提出问题:盐溶液的pH怎样呢?盐溶液显什么性呢?
猜想与假设:盐溶液的pH可能为:pH=7、pH<7、pH>7.
设计与实验:下列是两同学分别对相同的NaCl溶液、CuSO4溶液、K2CO3溶液的pH进行的测定实验:甲同学:取pH试纸放在玻片上,用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.乙同学:取pH试纸放在玻片上,用蒸馏水将pH试纸润湿,再用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.
记录数据:下表是两同学记录所测pH的实验数据:
NaCl溶液 | CuSO4溶液 | K2CO3溶液 | |
甲同学 | 7 | 4 | 10 |
乙同学 | 7 | 5 | 9 |
结论:通过测定几种盐溶液的pH,可以得出的结论是: .
评价与反思:上述两同学测得的数据,反映了溶液真实pH的是 同学。