题目内容
将60℃的硝酸钾饱和溶液冷却至室温,下列说法不正确的是( )
A.有晶体析出 B.溶质质量减少
C.溶剂质量不变 D.溶质质量分数增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种。同学们对该粉末进行了定性与定量研究。
(定性实验)
实验方案 | 实验现象 | 实验结论 |
取少量红色粉末放入试管中,滴加足量的稀盐酸振荡 | 红色粉末全部消失,溶液呈黄色 | 粉末为Fe2O3 |
______ | 粉末Cu | |
______ | 粉末为Fe2O3和Cu混合物 |
(定量实验)
(1)取该粉末4g放入硬质玻璃管中,先通CO,然后再用酒精喷灯加热一段时间,停止加热继续通入CO至装置冷却。实验装置如图:
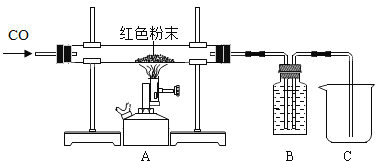
①实验时,先通CO再加热的目的是______。
②若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是_________,反应的化学方程式为________,该实验中B装置的作用是_________,其中盛放的试剂最好是________。
A NaOH溶液 B 稀盐酸 C 水
③若该粉末为铜粉和氧化铁的混合物,待装置完全冷却至室温,称量硬质玻璃管内剩余固体的质量为mg。则m的取值范围是________。
(2)若该粉末为铜粉和氧化铁的混合物,为了准确测定铜粉和氧化铁的混合物中氧化铁的质量分数,取10g样品于烧杯中,逐滴加入150g稀盐酸固体刚好不再溶解,过滤洗涤、恒温干、称量,剩余固体质量为2g,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O。
求:①混合物中氧化铁的质量分数______;②所用稀盐酸的质量分数______。
下列有关物质的检验、除杂、分离、区分所用的试剂或方法错误的是( )
选项 | 实验目的 | 所用试剂或方法 |
A | 检验NH4NO3溶液和K2SO4溶液 | NaOH溶液或Ba(NO3)2溶液 |
B | 除去生石灰中含有杂质石灰石 | 水或稀盐酸 |
C | 从H2O2溶液制氧气的残余物中分离出MnO2 | 过滤或蒸发 |
D | 区分失去标签的浓硫酸和稀硫酸 | 水或小木条 |
A.A B.B C.C D.D


 氯化钠的取用
氯化钠的取用 氯化钠的称量
氯化钠的称量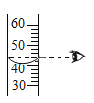 水的取用
水的取用 氯化钠的溶解
氯化钠的溶解