题目内容
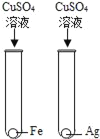
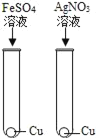
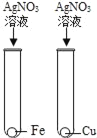
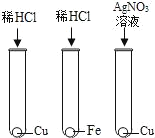
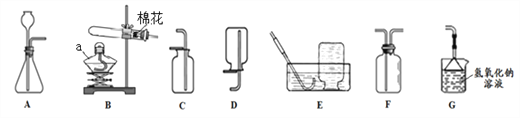
【题目】为探究铁、锌、铜、铝、银五种金属的活动性顺序,进行如图所示的实验。(实验前金属片表面均打磨过)
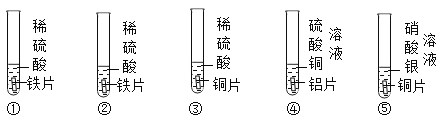
(1)实验④中反应的化学方程式为____________。
(2)通过以上实验可以得出什么结论___________?
(3)为证明五种金属的活动性顺序,在以上实验的基础上需要补做实验,要求除金属单质外,只能再选一种试剂,写出实验操作、现象和结论。___________
【答案】2Al+3CuSO4=Al2(SO4)3+3Cu 铝、锌、铁比铜活泼,铜比银活泼 取两支试管,分别加入适量硫酸锌溶液,其中1支试管中放入铁片,1支试管放入铝片,铁片表面无明显现象,说明锌比铁活泼,铝片表面附着银白色固体,说明铝比锌活泼
【解析】
(1)实验④中铝和硫酸铜反应生成硫酸铝和铜,反应的化学方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu.
故填:2Al+3CuSO4=Al2(SO4)3+3Cu.
(2)①中产生气泡,说明铁在金属活动性顺序中排在氢前面,②中产生气泡,说明锌在金属活动性顺序中排在氢前面,③中无明显现象,说明铜在金属活动性顺序中排在氢后面,④中铝片表面附着红色固体,说明铝比铜活泼,⑤中铜片表面附着银白色固体,说明铜比银活泼,因此可以得出什么结论是:铝、锌、铁比铜活泼,铜比银活泼.
故答案为:铝、锌、铁比铜活泼,铜比银活泼.
(3)实验方案是:取两支试管,分别加入适量硫酸锌溶液,其中1支试管中放入铁片,1支试管放入铝片,铁片表面无明显现象,说明锌比铁活泼,铝片表面附着银白色固体,说明铝比锌活泼.
故答案为:取两支试管,分别加入适量硫酸锌溶液,其中1支试管中放入铁片,1支试管放入铝片,铁片表面无明显现象,说明锌比铁活泼,铝片表面附着银白色固体,说明铝比锌活泼.

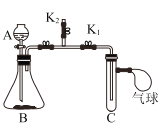
【题目】某同学利用图实验装置做了以下两个实验。
实验装置 | (实验一)研究燃烧条件 | (实验二)研究CO2与固体NaOH的反应 |
| 关闭K1和K2,在C中加入少量白磷,并加入热水浸没白磷。塞好胶塞,使导管口浸入热水中,发现白磷不燃烧;打开K2,将A中过氧化氢溶液滴入盛有MnO2的锥形瓶B中,马上关闭K2;打开K1,C中有气泡胃出,白磷立即燃烧 | 关闭K1和K2,A中盛有稀盐酸、B中盛放Na2CO3固体、C中是NaOH固体;打开K2,将A中液体滴人B中;一段时间后,用燃着的木条放在K2导管口,发现木条立即熄灭;再关闭K2,打开K1,待气球变鼓后,关闭K1,打开K2。 |
(1)实验一,锥形瓶B中发生的化学反应方程式为___。通过实验一可知,燃烧需要满足的一个条件是_______
(2)实验二,装药品前要检验B装置的气密性,需要进行的操作是_______
(3)两个实验中,气球分别所起的作用是_______