题目内容
常温下,一定质量的20%的烧碱溶液和一定质量的硫酸铜溶液恰好完全反应,滤出沉淀后,所得溶液的质量为142g,其中溶质的质量分数为10%,试求原硫酸铜溶液中溶质的质量分数(计算结果保留两位小数).
答案:
解析:
解析:
|
由题意知,所得Na2SO4溶液中Na2SO4的质量为142g×10%=14.2g,设参加反应的NaOH的质量为x、CuSO4的质量为y,生成Cu(OH)2的质量为z. 2NaOH+CuSO4=NaSO4+Cu(OH)2↓ 80 160 142 98 x y 14.2g z x= ∴NaOH溶液质量为:8g÷20%=40g CuSO4溶液质量为:(142+9.8-40)g=111.8g ∴原CuSO4溶液中CuSO4的质量分数= 答:原硫酸铜溶液中溶质的质量分数为14.31%. |

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
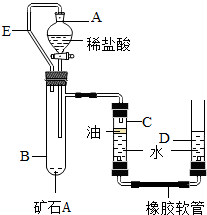 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
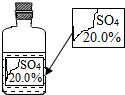
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数. 实验室有一瓶标签受损的无色溶液,如下图所示.老师要求同学们进行探究:这瓶溶液到底是什么溶液?
实验室有一瓶标签受损的无色溶液,如下图所示.老师要求同学们进行探究:这瓶溶液到底是什么溶液?