题目内容
(2012?萝岗区一模)实验室有一瓶标签受损的无色溶液,如图所示.老师要求同学们进行探究:这瓶溶液到底是什么溶液?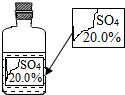
【提出猜想】提示:这瓶无色溶液只能是下列四种溶液中的一种:①硫酸镁溶液、②硫酸钠溶液、③硫酸溶液、④硫酸铵溶液
【查阅资料】
A:常温下,相关物质的溶解度如下:
B:MgSO4、(NH4)2SO4的水溶液显酸性
请回答:
(1)该无色溶液一定含有的离子是
【实验探究】(药品可自选)
(2)通过查阅资料(相关物质的溶解度表),小明同学认为猜想
(3)为确定其它几种猜想是否正确,小明同学设计实验继续进行探究:
小雅同学认为小明实验操作②的结论不正确,她的理由是

【提出猜想】提示:这瓶无色溶液只能是下列四种溶液中的一种:①硫酸镁溶液、②硫酸钠溶液、③硫酸溶液、④硫酸铵溶液
【查阅资料】
A:常温下,相关物质的溶解度如下:
| 物质 | MgSO4 | Na2SO4 | H2SO4 | (NH4)2SO4 |
| 溶解度 | 35.1g | 19.5g | 与水任意比互溶 | 75.4g |
请回答:
(1)该无色溶液一定含有的离子是
SO42-
SO42-
;【实验探究】(药品可自选)
(2)通过查阅资料(相关物质的溶解度表),小明同学认为猜想
②
②
(填序号)不成立,原因是Na2SO4饱和溶液的质量分数小于20%
Na2SO4饱和溶液的质量分数小于20%
;(3)为确定其它几种猜想是否正确,小明同学设计实验继续进行探究:
| 实验操作 | 实验现象 | 实验结论 |
| 取该溶液少许于试管中,向其中滴加 几滴 NaOH NaOH 溶液 |
溶液中有白色沉淀生成 | 猜想 ① ① (填序号)成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟比色卡对照 | 溶液pH小于7 |
猜想③成立 |
MgSO4、(NH4)2SO4的水溶液显酸性
MgSO4、(NH4)2SO4的水溶液显酸性
,请你写出实验操作①反应的化学方程式MgSO4+2NaOH═Na2SO4+Mg(OH)2↓
MgSO4+2NaOH═Na2SO4+Mg(OH)2↓
.分析:(1)根据残余的标签分析溶液中的离子;
(2)根据溶解度与饱和溶液的质量分数的关系分析;
(3)根据氢氧化钠能与硫酸镁反应生成沉淀分析猜想①;根据硫酸溶液显酸性,pH小于7分析猜想③;
(4)根据MgSO4、(NH4)2SO4的水溶液显酸性分析;根据实验操作①的反应,写出反应的方程式.
(2)根据溶解度与饱和溶液的质量分数的关系分析;
(3)根据氢氧化钠能与硫酸镁反应生成沉淀分析猜想①;根据硫酸溶液显酸性,pH小于7分析猜想③;
(4)根据MgSO4、(NH4)2SO4的水溶液显酸性分析;根据实验操作①的反应,写出反应的方程式.
解答:解:(1)由残余的标签可知,该无色溶液一定含有的离子是SO42-;
(2)由于某温度下饱和溶液的溶质质量分数的值不会大于该温度下溶质的溶解度.常温下硫酸钠的溶解度为19.5g,则常温下它的饱和溶液的溶质的质量分数=
×100%<20.0%,因此,该溶液不可能是硫酸钠,故猜想②不成立;
(3)①硫酸镁、硫酸、硫酸铵三种物质中,只有硫酸镁能与碱溶液氢氧化钠溶液形成氢氧化镁沉淀,因此,观察到出现白色沉淀就可判断溶液为硫酸镁溶液.所以,猜想①成立;
②由于硫酸溶液呈酸性,溶液的pH小于7,所以,猜想③成立;
由于MgSO4、(NH4)2SO4的水溶液也显酸性,所以,小雅同学认为小明实验操作②的结论不正确的.在实验操作①中,硫酸镁和氢氧化钠反应生成了氢氧化镁沉淀和硫酸钠,反应的方程式是:MgSO4+2 NaOH═Na2SO4+Mg(OH)2↓.
故答为:(1)SO42-;(2)②,常温下,Na2SO4饱和溶液的质量分数小于20%;(3)①NaOH,①,理由:MgSO4、(NH4)2SO4的水溶液显酸性,MgSO4+2 NaOH═Na2SO4+Mg(OH)2↓.
(2)由于某温度下饱和溶液的溶质质量分数的值不会大于该温度下溶质的溶解度.常温下硫酸钠的溶解度为19.5g,则常温下它的饱和溶液的溶质的质量分数=
| 19.5g |
| 100g+19.5g |
(3)①硫酸镁、硫酸、硫酸铵三种物质中,只有硫酸镁能与碱溶液氢氧化钠溶液形成氢氧化镁沉淀,因此,观察到出现白色沉淀就可判断溶液为硫酸镁溶液.所以,猜想①成立;
②由于硫酸溶液呈酸性,溶液的pH小于7,所以,猜想③成立;
由于MgSO4、(NH4)2SO4的水溶液也显酸性,所以,小雅同学认为小明实验操作②的结论不正确的.在实验操作①中,硫酸镁和氢氧化钠反应生成了氢氧化镁沉淀和硫酸钠,反应的方程式是:MgSO4+2 NaOH═Na2SO4+Mg(OH)2↓.
故答为:(1)SO42-;(2)②,常温下,Na2SO4饱和溶液的质量分数小于20%;(3)①NaOH,①,理由:MgSO4、(NH4)2SO4的水溶液显酸性,MgSO4+2 NaOH═Na2SO4+Mg(OH)2↓.
点评:本题的综合性较强,涉及基础知识和技能较多,准确掌握饱和溶液溶质质量分数与溶解度的关系、铵根的检验、溶液酸碱性与pH关系等知识,是解答本题的基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?萝岗区一模)锶元素(元素符号为Sr)原子结构示意图如图所示,下列说法错误的是( )
(2012?萝岗区一模)锶元素(元素符号为Sr)原子结构示意图如图所示,下列说法错误的是( )