题目内容
化学实验小组讨论测定双氧水溶液中溶质的质量分数的实验方案.查阅资料:常温下氧气密度为1.42g/L.
设计原理:将一定质量的双氧水样品与二氧化锰混合,测定反应产生氧气的质量.
过程方法:
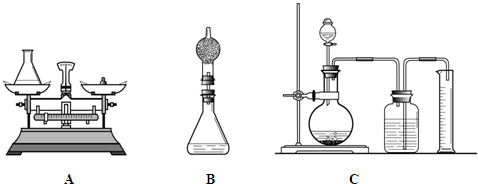
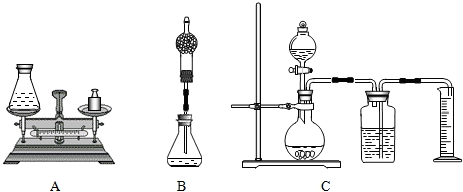
(1)组长首先设计了A装置:向质量为75 g的锥形瓶中加入0.5g二氧化锰和20 g双氧水溶液,待反应完毕后测得锥形瓶和反应后混合物的总质量为94.7g.请写出该反应的化学方程式
(2)小林对组长的设计提出质疑并设计B装置进行实验(在锥形瓶上加一干燥管),请说明小林质疑的理由是
(3)小明通过思考后,觉得他们的方案误差都较大,于是小明设计了C装置(试剂用量不变).要满足实验的要求减少误差,小明需选用
分析:(1)氧气的制取实验中,要测定双氧水溶液中溶质的质量分数,应该知道溶质的质量和溶液的质量,而根据题目中提供的信息,需要根据反应的化学方程式,利用氧气的质量进行求算.
(2)而要想准确的计算,氧气的质量就是一个关键,由于氧气是从溶液中中逸出,会带有水蒸气,导致结果不够准确,所以得设法除去水蒸气.
(3)要想确定量筒的取用,必须知道此时能产生的氧气的体积.
(2)而要想准确的计算,氧气的质量就是一个关键,由于氧气是从溶液中中逸出,会带有水蒸气,导致结果不够准确,所以得设法除去水蒸气.
(3)要想确定量筒的取用,必须知道此时能产生的氧气的体积.
解答:答:(1)要求双氧水溶液中溶质的质量分数,必须根据制取氧气的化学方程式来进行求算,反应前物质的总量为95.5g,反应后物质的总量为94.7g,所以生成氧气的质量为95.5g-94.7g=0.8g,设双氧水中溶质的质量为x,则
2H2O2
2H2O+O2↑
68 32
x 0.8g
=
,x=1.7g
所以 H2O2;%=
×100%=8.5%
所以本题答案为:2H2O2
2H2O+O2↑ 8.5%
(2)考虑到制取氧气的药品状态,双氧水为液态,当氧气从溶液中逸出时会带走水蒸气,所以本题答案为:氧气会带走水蒸气.
(3)分析题目可以知道,此时收集到的氧气的体积为:
=0?563L,约563mL,所以本题答案为:600mL量筒(因为产生氧气的体积约是563mL).
2H2O2
| ||
68 32
x 0.8g
| 68 |
| x |
| 32 |
| 0?8g |
所以 H2O2;%=
| 1?7 |
| 20g |
所以本题答案为:2H2O2
| ||
(2)考虑到制取氧气的药品状态,双氧水为液态,当氧气从溶液中逸出时会带走水蒸气,所以本题答案为:氧气会带走水蒸气.
(3)分析题目可以知道,此时收集到的氧气的体积为:
| 0?8g |
| 1?42g/L |
点评:本题综合考查了氧气的制取以及根据化学方程式进行的计算,完成此类题目应该具备综合分析问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目