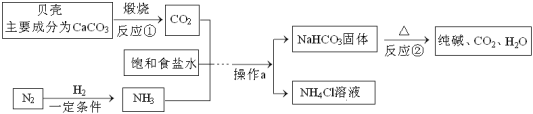
题目内容
【题目】将下列金属活动性顺序表补充完整。

(1)用CuSO4 配制农药波尔多液时不能在以下______(填序号)中进行。
A 塑料桶 B 铁桶 C 木桶
(2)下列方案中能比较出铁、锌、银活动性强弱顺序的有______。
A 铁片、锌片、银片、10%的稀盐酸
B 铁丝、锌粉、银粉、5%的稀盐酸
C 铁片、锌片、AgNO3溶液
D 铁丝、Zn(NO3)2溶液、AgNO3溶液
E 锌片、银片、FeSO4溶液
【答案】B ADE
【解析】
解:(1)由金属活动性顺序表可知,将金属活动性顺序表补充完整如下图:
(2)不能用铁制容器盛放波尔多液,这是因为铁能和硫酸铜反应生成硫酸亚铁和铜,故选B;
(3))A、将铁片、锌片、银片分别加入10%的稀盐酸中,锌反应较快,铁反应较慢,银不反应,可比较出铁、锌、银活动性强弱。故A正确;
B、由于铁丝、锌粉的表面积不同,无法比较金属反应的速率,不能判断金属的活动性,故B错误;
C、铁片、锌片都能与AgNO3溶液反应,能比较出铁、锌的活动性大于银,但不能比较铁、锌的活动性强弱,故C错误;
D、铁丝不能与Zn(NO3)2溶液反应,能与AgNO3溶液,可比较出,铁、锌、银活动性强弱。故D正确;
E、锌片能与FeSO4溶液反应,银片不能与FeSO4溶液反应,可比较出铁、锌、银活动性强弱。故E正确。故选ADE。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】用已知溶质质量分数的溶液可以测定未知溶液的溶质质量分数。实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量。
②往上述锥形瓶中逐滴加入溶质质量分数为 16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量。数据如下表:
锥形瓶 | 锥形瓶+稀盐酸 | 锥形瓶+反应后溶液 | |
质量/克 | 35.5 | 55.5 | 80.5 |
(1)实验中消耗的氢氧化钠溶液质量为______克。
(2)反应后溶液中的溶质质量分数是多少______?
(3)另有同学做了同样的实验,却得到不同的结果。用精密pH试纸测得反应后锥形瓶内溶液的pH为7.8,则他测出的盐酸溶质质量分数偏大还是偏小,造成偏差的原因是______。