题目内容
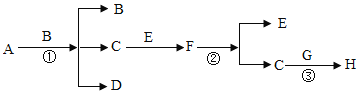
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
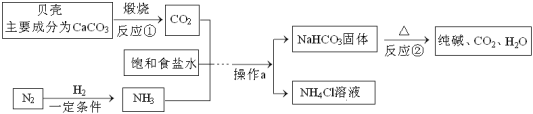
(1)反应①的化学方程式______,反应②的基本反应类型为______。
(2)纯碱的化学式为______,所属物质的类别是____。纯碱溶液能使酚酞显__色
(3)工业上用分离液态空气的方法制取氮气,属于___变化(填“物理”或“化学”)。写出合成氨气的化学方程式_____________。
(4)操作a的名称是____,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、____。
(5) NH4Cl溶液中会电离出自由移动的__和__(填离子符号),写出NH4Cl的一种用途____。
【答案】CaCO3![]() CaO+CO2
CaO+CO2![]() 分解反应 Na2CO3 盐 红 物理 N2+3H2
分解反应 Na2CO3 盐 红 物理 N2+3H2![]() 2NH3 过滤 漏斗 NH4+ Cl- 氮肥
2NH3 过滤 漏斗 NH4+ Cl- 氮肥
【解析】
(1)反应①煅烧石灰石,产生氧化钙和二氧化碳气体,方程式为:CaCO3![]() CaO+CO2
CaO+CO2![]() ,
,
反应②是碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,反应物只有一种,生成三种物质,属于分解反应;
(2)纯碱即碳酸钠,化学式为Na2CO3,属于盐类物质,但碳酸钠的水溶液呈碱性,因此能使酚酞溶液变红;
(3)工业上用分离液态空气的方法制取氮气只是将氮气从空气中分离出来,没有生成新物质,属于物理变化;氮气和氢气在一定条件下生成氨气,方程式为N2+3H2![]() 2NH3
2NH3
(4)经过操作a,将化合物分成了固体和液体两个部分,因此,操作a是过滤,需要用到的玻璃仪器有漏斗、烧杯和玻璃棒;
(5)氯化铵是由氯离子和铵离子构成的,在水中能电离出NH4+和Cl-,氯化铵可以作为氮肥使用。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钢铁工业是国家工业的基础.
(1)图1是教材中炼铁高炉及炉内化学变化过程示意图,根据图示回答问题.若图1中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:A区_____;B区(焦炭的作用)_____、_____.
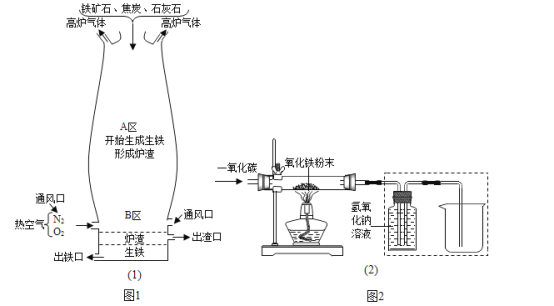
(2)某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究.
[设计实验]用一氧化碳还原纯净的氧化铁 粉末,实验装置如图2.
[进行实验]该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g) ②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量).
[分析与讨论]本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
[查阅资料]
物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 红色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
③四氧化三铁、铁粉都能被磁铁吸引,而氧化亚铁、氧化铁均不能被磁铁吸引.
[实验与猜想]
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有_____和_____.
②进行猜想:黑色固体粉末可能
a.全部为铁 b._____ c._____.
[得出结论]
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)_____.
计算过程:
[反思与评价]
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有_____.
A 收集一氧化碳 B 吸收二氧化碳 C 检验二氧化碳.
【题目】结合图1化学实验装置,回答有关问题。
I某化学兴趣小组进行如下系列实验。请根据下图回答问题:
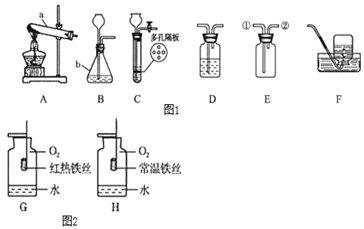
(1)写出图中标有宇母的仪器的名称: b__________
(2)写出实验室用A装置取氧气的化学方程式 ______ ,制得的氧气用来做如图2所示的实验,发现H中铁丝不燃烧,其原因是_________。
(3)实验室制取二氧化碳常用的药品是_____,若用装置E收集二氧化碳,则气体应从_____ 填 “①”或“②“)端进入;若要获得干燥的二氧化碳,可将装置B和装置D用胶皮管连接,并在装置D中盛放___________(填物质名称)试剂。
(4)实验室常用装置C代替装置B制取气体,装置C的优点是__________
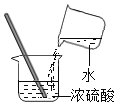
II某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(提出问题)①该瓶溶液中溶质的成分是什么?②该瓶溶液中亚硫酸钠的质量分数是多少?
(查阅资料)
(1)Na2SO3有较强还原性,在空气中易被氧气氧化:2 Na2SO3+O2==2Na2SO4;
(2)Na2SO3能与酸反应产生SO2气体;
(3)SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
(作出猜想)
猜想1:没有变质,成分是Na2SO3;猜想2完全变质,成分是Na2SO4;
你认为还可能有的猜想3:_____________________。
(实验探究I)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸 | _____ | 已部分变质 |
(评价)有同学质疑甲组方案不合理,理由是___________。
(实验探究II)
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
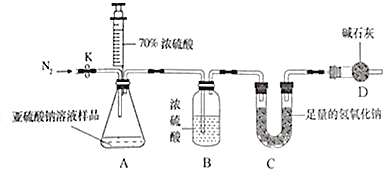
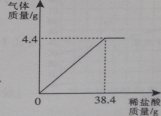
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g。
D装置的作用为_____________ , 计算出该溶液中Na2SO3的质量分数为______;
(解释)若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的____(填”偏小”或”偏大”)。(反思)由此可得出,保存亚硫酸钠时应__________。