题目内容
(6分)化学小组同学在实验室发现了三瓶无标签待区分的白色固体,标为A、B、C分别是碳酸钠、硫酸钠、碳酸钙中的一种。(提示:可溶性的钡盐有毒)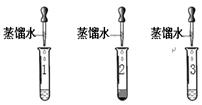
【提出问题】如何区分出三种物质?
【进行实验】甲、乙两位同学进行了如下实验:
步骤一:甲、乙的实验设计与操作相同,分别取A、B、C 瓶中的样品少量于试管中,试管编号对应记为1、2、3号,加等量的水,观察到2号中产生白色浑浊,1、3号中得到无色溶液。
步骤二:甲、乙的实验操作如下图所示:


【表达与交流】乙认为甲的实验无法区分1、3号溶液,理由是(1)
。
【证据与结论】经过思考,甲在步骤二的基础上,继续向1、3号管中加入足量稀盐酸,1号中产生的明显现象是(2) ,产生此现象的化学方程式为(3) 。乙同学在区分1、3号中的溶液时选择的与甲不同类别的某试剂是(4) 。两位同学通过实验都区分出了三种固体。请将三种固体物质的化学式分别标在广口瓶的标签上(5)。
【反思与评价】对比甲、乙的实验,请你从安全性、简约性的角度对甲或乙同学的实验进行评价 (6) 。
(1)由步骤一中的实验现象可知2号对应的B瓶中的物质是碳酸钙,所以1、3两管中是硫酸钠、碳酸钠溶液,分别加入氯化钡溶液会产生硫酸钡和碳酸钡白色沉淀,所以无法区分两种物质
(2)白色固体(逐渐减少至)消失,产生气泡
(3)BaCO3+2HCl=BaCl2+H2O+CO2↑
(4)酚酞溶液(或紫色石蕊溶液)
(5)见右图(1分)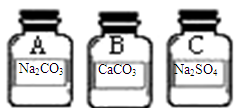
(6)安全性:甲的实验设计不如乙好,甲在实验中使用并生成了氯化钡溶液,氯化钡为重金属盐,其溶液有毒,可能会危害人体健康。若废液未经处理即直接排放会造成水体污染(不符合绿色化学理念);简约性:乙同学的实验设计比甲好,他选用了两种试剂、通过两步实验就区分三种物质,实验步骤少,使用试剂种类少
解析试题分析:(1)乙认为甲的实验无法区分1、3号溶液,理由是:由步骤一中的实验现象可知2号对应的B瓶中的物质是碳酸钙,所以1、3两管中是硫酸钠、碳酸钠溶液,分别加入氯化钡溶液会产生硫酸钡和碳酸钡白色沉淀,所以无法区分两种物质
(2) 步骤二的甲实验加入氯化钡溶液发生的反应:Na2SO4+BaCl2==BaSO4↓+2NaCl,Na2CO3+BaCl2==BaCO3↓+2NaCl,而碳酸钡沉淀会溶于盐酸,1号中产生的明显现象是:白色固体(逐渐减少至)消失,产生气泡
(3) 产生上述现象的化学方程式为 :BaCO3+2HCl=BaCl2+H2O+CO2↑
(4)乙同学在区分1、3号中的溶液时选择的与甲不同类别的某试剂,甲选的是盐溶液,所以可根据碳酸钠溶液呈碱性,所以可选择酚酞溶液(或紫色石蕊溶液)来区分
(5)根据上面的推断,故A为碳酸钠溶液,B为碳酸钙,C为硫酸钠,见上图
(6)对比甲、乙的实验,从安全性、简约性的角度对甲或乙同学的实验进行评价:安全性:甲的实验设计不如乙好,甲在实验中使用并生成了氯化钡溶液,氯化钡为重金属盐,其溶液有毒,可能会危害人体健康。若废液未经处理即直接排放会造成水体污染(不符合绿色化学理念);简约性:乙同学的实验设计比甲好,他选用了两种试剂、通过两步实验就区分三种物质,实验步骤少,使用试剂种类少
考点:碳酸钠、硫酸钠、碳酸钙物质的化学性质,实验方案的对比

(7分)实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).
小强和小华同学很感兴趣,决定对其成分进行探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 ( )
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ初中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3.
ⅡNa2CO3和NaHCO3的水溶液都呈碱性.
Ⅲ室温(20℃)时,测定四种物质的溶解度数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是
【实验探究】
(1)小强用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验.
| 实验步骤 | 实验现象 | 结论及化学方程式 |
| 取少量溶液于试管中,滴加 | 产生大量气泡 | 反应的化学方程式: |
| 把产生的气体通入澄清的石灰水中. | 澄清的石灰水变浑浊 | 猜想②正确. 反应的化学方程式: |
(6分)为了探究复分解反应的实质,某兴趣小组同学对H2SO4与Ba(NO3)2的反应进行如下实验探究。
【提出问题】物质发生复分解反应时,是不是所有的离子都参加了反应。
【设计实验】
| 实验步骤 | 实验操作 | 实验现象 |
| 第一步 | 取一支洁净的试管,向其中加入一定量的稀硫酸溶液,再慢慢滴加Ba(NO3)2溶液至恰好完全反应。 | |
| 第二步 | 在上述反应后的试管中再滴加3滴紫色石蕊试液。 | 试管中溶液由无色变成红色 |
【查阅资料】盐与酸和碱一样,溶于水之后也会发生解离成组成它的离子,如:Ba(NO3)2在水中会解离出Ba2+和NO3-。
【实验结论】(2)上述反应的实质是 和 (填离子符号)之间发生的反应。
【应用结论】(3)碳酸钾和澄清石灰水反应的实质是 和 (填离子符号)之间发生的反应,反应后的溶液中还存在大量的 离子,向反应后的溶液中滴加无色酚酞,溶液将变成 色。
(22分)著名侯氏制碱法的重要反应之一:NH3 +CO2 +H2O+NaCl ="=" NaHCO3 +NH4Cl。在生产中,NaHCO3易结晶析出,经过滤得到NaHCO3晶体和滤液。某化学兴趣小组欲探究所得滤液中溶质的成分,及制得的纯碱样品中Na2CO3的质量分数,请你参与他们的探究活动。
【查阅资料】Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.2NaHCO3 △ Na2CO3 +CO2↑+H2O; NH4Cl △ NH3↑+HCl↑。
Ⅲ.NaCl溶液与AgNO3溶液反应产生不溶于稀HNO3的白色沉淀。
【探究实验1】滤液中含有的溶质是什么?
【作出猜想】猜想1:NH4Cl 猜想2:NaHCO3 猜想3:NaCl
猜想4:……
【交流与讨论】(1)化学兴趣小组认为溶质含有NaCl,理由是 。
(2)化学兴趣小组经过讨论,认为猜想4可能是 。
【实验推断】
| 实验步骤 | 实验现象 | 实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口。 | | 滤液中含有NH4Cl,有关化学方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
| ②另取少量滤液于试管中,滴加稀盐酸。 | 产生无色 无味气体。 | 滤液中含有 ,有关化学方程式: 。 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液。 | 产生白色沉淀。 | 滤液中含有 ,滤液蒸干后充分灼烧的目的是 。 |
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 | 产生白色沉淀。 | 反应的化学方程式: 。 |
(3)应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算Na2CO3 的质量分数为96%。如果不洗涤沉淀物会造成测定结果大于96%,这是因为 。





