题目内容
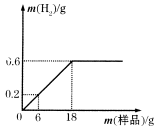
【题目】已知:2KClO3![]() 2KCl+3O2↑,下图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
2KCl+3O2↑,下图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )

A. 固体中氧元素的质量 B. 生成O2的质量
C. 固体中MnO2的质量 D. 固体中钾元素的质量分数
【答案】A
【解析】A、反应后生成的氧气逸出,固体中氧元素的质量从开始反应就不断减少,反应停止后不变,由于二氧化锰中也有氧元素,最后不能为0,正确;B、生成氧气的质量从开始反应不断增加,图中表示在不断减少,错误;C、二氧化锰在反应中为催化剂,反应前后质量不变,图中表示在不断减少,错误;D、反应前后固体中钾元素的质量不变,固体质量减少,钾元素的质量分数增大,图中表示在不断减少,错误。故选A。

【题目】下列实验中,对应的现象以及结论都正确的是
选项 | A | B | C | D |
实验 |
|
|
|
|
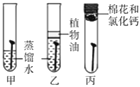
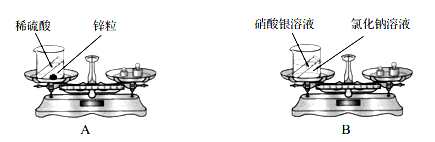
现象 | 红磷熄灭冷却后,打开弹簧夹,水倒流入集气瓶,约占集气瓶容积的1/5 | 石蕊变红 | 黑色粉末变成红色 | 甲中铁钉生锈,乙、丙中铁钉无明显变化 |
结论 | 氧气约占空气质量的1/5 | 二氧化碳具有酸性 | 一氧化碳具有还原性 | 铁生锈需要与水和氧气同时接触 |
A. A B. B C. C D. D
【题目】氢氧化镍[Ni(OH)2]是某种混合动力汽车电池的一种材料。请参与下列探究:
【查阅资料】
Ⅰ.氢氧化是一种蓝绿色微溶于水的固体;硫酸镍溶液呈绿色;碳酸镍是一种浅绿色固体。
Ⅱ.能溶于水的酸、碱、盐溶于水时能电离成离子即以离子的形式存在,如:H2SO4=2H++SO42—;水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
(1)取少量Ni(OH)2(新制)悬浊液于试管中,滴加过量稀硫酸,振荡 | 悬浊液变澄清,溶液呈绿色 | __________________ |
(2)取少量氢氧化镍(新制)悬浊液于试管中,滴加过量NaCO3溶液 | ______________ | Ni(OH)2能和NaCO3溶液反应 |
(3)向步骤(1)所得的澄清液中,滴加少量NaOH溶液 | 无明显现象 | 硫酸镍溶液不能和NaOH溶液反应 |
【分析讨论】
(1)Ni(OH)2中Ni的化合价为_____________。
(2)氢氧化镍和稀硫酸反应的化学方程式_______________________________。
(3)由上述实验可知,氢氧化镍在水中的溶解能力_____________(填:“大于”、“等于”或“小于”)碳酸镍。
(4)小顾认为步骤(3)得出的结论不合理,其理由是____________________。