题目内容
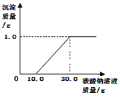
【题目】为测定某样品(碳酸钠和氯化钠的混合物)中碳酸钠的质量分数,某化学兴趣小组进行以下实验,取50g的样品放置于烧杯中,然后取一定溶质质量分数的稀盐酸200g,分四等分,每次向装样品的烧杯中加入50g,实验测得加入稀盐酸的质量与反应后烧杯中物质的总质量的关系如下表。求:
加入稀盐酸的质量/g | 50 | 100 | 150 | 200 |
反应后烧杯中物质的总质量/g | 91.2 | 132.4 | 182.4 | m |
(1)表中m的值为________。
(2)样品中碳酸钠的质量分数是________(精确到0.1%)。
(3)所用稀盐酸的溶质质量分数________(写出具体的计算过程)。
【答案】232.4g 84.8% 29.2%
【解析】
(1)根据第一次加入盐酸,反应后烧杯中物质的质量减少50g+50g-91.2g=8.8g,第二次加盐酸,反应后烧杯中物质的质量减少50g+100g-132.4g=17.6g,第三次加盐酸,反应后烧杯中物质的质量减少50g+150g-182.4g=17.6g,第二次和第三次减少量相同,说明气体不再产生,则第四次加盐酸,反应后烧杯中物质的质量减少17.6g,则m=50g+200g-17.6g=232.4g,故填232.4g;
(2)根据第二次和第三次质量减少量相同可知,总共产生二氧化碳的质量为17.6g,
解:设样品中碳酸钠的质量为x
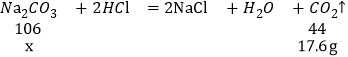
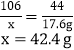
样品中碳酸钠的质量分数=![]()
(3)50g盐酸与碳酸钠反应生成二氧化碳的质量是8.8g,
解:设50g盐酸溶液中溶质的质量为y
![]()
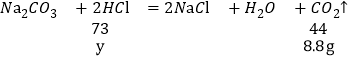
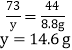
所用稀盐酸的溶质质量分数:![]()

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目