题目内容
【题目】(1)用化学用语填空:保持氮气化学性质的最小粒子____________;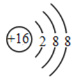 ____________。
____________。
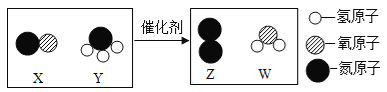
(2)随着科学的发展,新能源的开发不断取得突破。清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)所示。请根据微观示意图回答以下问题。
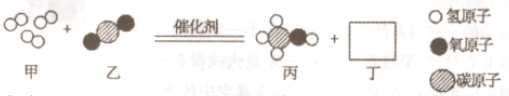
丁的化学式为____________,将二氧化碳转化成液体燃料甲醇可以减缓____________。
(3)我国化工专家侯德榜发明的“联合制碱法”为世界制碱工业做出了突出贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。下表是几种物质在不同温度时的溶解度:
温度(℃) | 20 | 40 | 50 | 60 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 | 37.3 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | |
Na2CO3 | 21.8 | 48.9 | 47.5 | 46.5 | |
①20℃时,100克水中最多溶解Na2CO3____________克。
②60℃,分别取 Xg NaCl和XgNH4Cl固体加入两只烧杯中,进行如下实验。

加入甲烧杯中的固体是__________,甲烧杯中未溶解的固体最多有_____________g。
③下列说法正确的是________(填字母编号)。
A 该生产原料之一是饱和食盐水,室温下配制饱和食盐水的质量分数约为26.5%
B 生产中需通入氨气及二氧化碳,若要提高这些气体的溶解度,可通过增加水量来提高
C NH4C1和NaC1混合溶液中可以通过蒸发结晶的方法获得较多的NH4C1晶体
D “联合制碱法”得到的产品之一NH4Cl可作为氮肥使用
【答案】N2 S2- H2O 温室效应 21.8 氯化钠 17.9 AD
【解析】
(1)氮气是由氮分子构成的,构成物质的分子是保持该物质化学性质的最小粒子,故保持氮气化学性质的最小粒子是氮分子,分子用化学式表示,表示为:N2;
质子数大于核外电子数,表示阴离子,质子数=原子序数=16,16号元素为硫元素,故该粒子为硫原子得到2个电子后形成的硫离子,离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,故硫离子表示为:S2-;
(2)根据质量守恒定律,化学反应前后,原子的种类和数目不变,由图可知,反应物中含1个碳原子、2个氧原子、6个氢原子,生成物中含1个碳原子、1个氧原子、4个氢原子,故生成物中还应含1个氧原子,2个氢原子,故丁的化学式为:H2O;
将二氧化碳转化为甲醇,可以减少空气中二氧化碳的含量,减缓温室效应;
(3)①由表中数据可知,20℃时,碳酸钠的溶解度为21.8g,即该温度下,100g水中最多能溶解21.8g碳酸钠,故填:21.8;
②由图可知,60℃时,氯化钠的溶解度是37.3g,氯化铵的溶解度是55.2g,该温度下,分别取 Xg NaCl和XgNH4Cl固体加入两只烧杯中,各加100g水,甲有固体未溶解,乙固体全部溶解,已知该温度下,氯化铵的溶解度大于氯化钠,故加入甲烧杯中的固体是氯化钠;
乙全部溶解,乙可能恰好达到饱和,也可能是不饱和溶液,当乙恰好饱和时,溶解的质量最大,这时甲未溶解的固体最多,如果乙恰好达到饱和,则加入甲、乙的质量为55.2g,甲未溶解的固体质量为:55.2g-37.3g=17.9;
③A、由表中数据可知,20℃时,氯化钠的溶解度是36g,该温度下,饱和食盐水的溶质质量分数为:![]() ,符合题意;
,符合题意;
B、在压强、温度一定的条件下,溶解度是一个定值,不随水的质量增加而增加,不符合题意;
C、由表中数据可知,氯化钠、氯化铵的溶解度都随温度的升高而增加,氯化铵的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故NH4Cl和NaCl混合溶液中可以通过降温结晶的方法获得较多的NH4Cl晶体,不符合题意;
D、氯化铵含营养元素氮元素,属于氮肥,符合题意。
故选AD。