题目内容
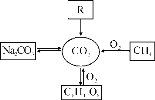
【题目】工业上制造高纯度CaO的主要流程示意图如下:
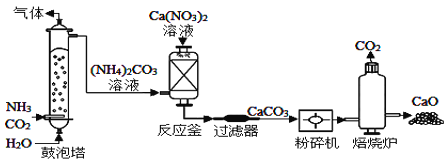
(1)CaCO3物质类别属于_____
(2)反应釜中的反应属于复分解反应,其化学方程式是_____。
(3)碳酸钙进入焙烧炉前,先要粉碎的目的是_____,最后取出的CaO要立即放入干燥器,其原因是_____(用化学方程式表示)。
(4)理论上5tCaCO3制出CaO的质量是多少t?_____
【答案】盐 (NH4)2CO3+Ca(NO3)2=CaCO3↓+2NH4NO3 增大反应物的接触面积,加快反应速率,使其充分反应 CaO+H2O=Ca(OH)2 2.8t
【解析】
(1)碳酸钙含钙、碳、氧三种元素,是由钙离子和碳酸根离子组合成的,属于盐
(2)根据图中给出信息反应釜中为(NH4)2CO3和Ca(NO3)2发生复分解反应,因此反应方程式为(NH4)2CO3+Ca(NO3)2=CaCO3↓+2NH4NO3
(3)粉碎后碳酸钙的颗粒变得更小,同样体积下表面积增大了,更容易反应,颗粒小了反应更加完全。CaO非常容易和水发生反应生成Ca(OH)2,方程式为CaO+H2O=Ca(OH)2
(4)解:设生成xtCaO。
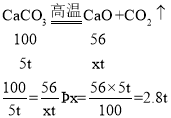
答:理论上生成的CaO的质量是2.8t。
故答案为盐;(NH4)2CO3+Ca(NO3)2=CaCO3↓+2NH4NO3;增大反应物的接触面积,加快反应速率,使其充分反应;CaO+H2O=Ca(OH)2;2.8t

练习册系列答案
相关题目