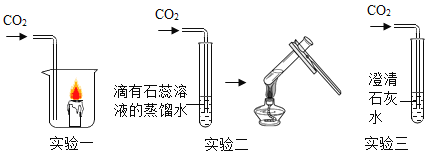
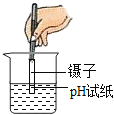
题目内容
【题目】某有机物6.0g在空气中完全燃烧,共得到8.8g二氧化碳和3.6g水,则该化合物的组成元素是( )
A.该物质由碳、氢、氧三种元素组成
B.该物质只含有碳、氢两种元素
C.一定含有碳、氢元素,可能含有氧元素
D.该物质的分子中碳原子和氢原子的个数比为1:2
【答案】A
【解析】
6g某物质在空气中完全燃烧生成8.8g二氧化碳和3.6g水,根据质量守恒定律,生成的8.8g二氧化碳中的碳元素和3.6g水中氢元素均来自于6g的某物质,利用碳、氢元素的质量及某物质的质量。
A、8.8g二氧化碳中碳元素的质量为![]() ;3.6g水中氢元素的质量为
;3.6g水中氢元素的质量为
![]() ,由质量守恒定律,该物质中碳、氢元素质量和为
,由质量守恒定律,该物质中碳、氢元素质量和为
![]() ,小于该物质的质量6g,因此该物质中除碳、氢元素外还应含有氧元素(其质量为
,小于该物质的质量6g,因此该物质中除碳、氢元素外还应含有氧元素(其质量为![]() ),故A正确;
),故A正确;
B、由A选项的分析,该物质是由碳、氢、氧三种元素组成的,故B不正确;
C、由A选项的分析,该物质是由碳、氢、氧三种元素组成的,故C不正确;
D、碳元素和氧元素的质量比为![]() ,碳元素和氧元素的相对原子质量为12和16,则该物质的分子中碳原子与氢原子的个数比为
,碳元素和氧元素的相对原子质量为12和16,则该物质的分子中碳原子与氢原子的个数比为![]() ,故D不正确。故选A。
,故D不正确。故选A。

【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
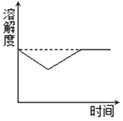
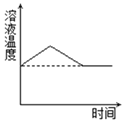
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。