题目内容
 如图是某种胃药的部分标识.胃药中所含的物质能中和胃里过多的胃酸.某患者按标识上的服用方法服药,服药后病情好转.计算:
如图是某种胃药的部分标识.胃药中所含的物质能中和胃里过多的胃酸.某患者按标识上的服用方法服药,服药后病情好转.计算:(1)氢氧化镁中,镁、氧、氢各元素的质量比为
(2)该患者服用此胃药3天,有
(3)11.6g氢氧化镁中所含镁元素质量与
考点:元素质量比的计算,化合物中某元素的质量计算
专题:化学式的计算
分析:(1)各元素相对原子质量总和的比即为质量比;
(2)首先可计算三天内患者共服用胃药2×3×3=18片,然后算出18片胃药含Mg(OH)2中镁元素的质量,即可解答;
(3)根据镁元素的质量相等列方程解答即可.
(2)首先可计算三天内患者共服用胃药2×3×3=18片,然后算出18片胃药含Mg(OH)2中镁元素的质量,即可解答;
(3)根据镁元素的质量相等列方程解答即可.
解答:解:(1)氢氧化镁中镁、氧、氢三种元素的质量比为:24×1:16×2:1×2=12:16:1;
故答案为:12:16:1;
(2)首先可计算三天内患者共服用胃药2×3×3=18片,然后算出18片胃药含Mg(OH)2中镁元素的质量:250mg×18×
×100%=1862.1mg;
故答案为:1862.1mg;
(3)设,质量为x的氧化镁与11.6g氢氧化镁中所含镁元素质量相等;
11.6g×
×100%=x×
×100%
x=8g
故答案为:8g.
故答案为:12:16:1;
(2)首先可计算三天内患者共服用胃药2×3×3=18片,然后算出18片胃药含Mg(OH)2中镁元素的质量:250mg×18×
| 24 |
| 58 |
故答案为:1862.1mg;
(3)设,质量为x的氧化镁与11.6g氢氧化镁中所含镁元素质量相等;
11.6g×
| 24 |
| 58 |
| 24 |
| 40 |
x=8g
故答案为:8g.
点评:组成元素的质量=化合物的质量×化合物中元素的质量分数,其中元素的质量分数可由化学式计算得到.

练习册系列答案
相关题目
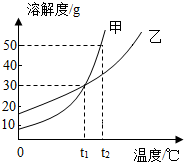 甲、乙两物质的溶解度曲线如图所示,请你回答下列问题:
甲、乙两物质的溶解度曲线如图所示,请你回答下列问题: