题目内容
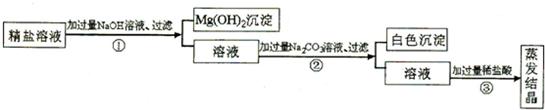
某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2.小青同学设计了以下实验方案来除去可溶性杂质.
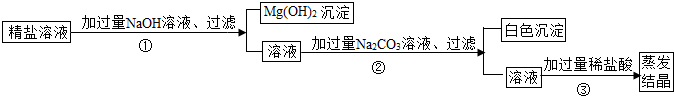
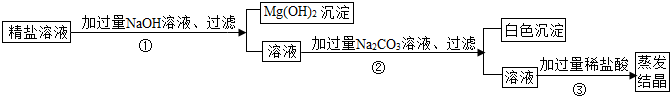
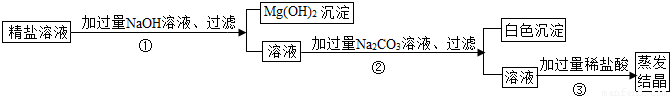
(1)步骤①的化学方程式为________.
(2)步骤②中得到的白色沉淀是________(填化学式).
(3)步骤③中加稀盐酸是为了除去溶液中的________,蒸发结晶何时停止加热________.
解:(1)在步骤①加入的氢氧化钠能与粗盐中的氯化镁反应,生成了氢氧化镁沉淀和氯化钠,反应的方程式是:MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(2)步骤②中加入的碳酸钠能与氯化钙反应生成了CaCO3沉淀和氯化钠;
(3)由于溶液中存在过量的氢氧化钠、碳酸钠.所以,骤③中加稀盐酸是为了除去溶液中的过量的碳酸钠和氢氧化钠,蒸发结晶时当蒸发皿中有大量固体析出时停止加热.
故答为:(1)MgCl2+2NaOH=2NaCl+Mg(OH)2↓;(2)CaCO3;(3)过量的碳酸钠和氢氧化钠,蒸发皿中有大量固体析出时.
分析:(1)根据氯化镁与与氢氧化钠的反应写出反应的方程式;
(2)根据氯化钙与碳酸钠的反应分析生成的沉淀;
(3)根据溶液中含有的氢氧化钠、碳酸钠分析加入加稀盐酸的目的,根据蒸发的操作分析.
点评:本题考查综合,既考查了粗盐提纯实验的有关注意事项,又考查了如何除去粗盐中的可溶性杂质的问题,解答时要依据相关知识细心分析.
(2)步骤②中加入的碳酸钠能与氯化钙反应生成了CaCO3沉淀和氯化钠;
(3)由于溶液中存在过量的氢氧化钠、碳酸钠.所以,骤③中加稀盐酸是为了除去溶液中的过量的碳酸钠和氢氧化钠,蒸发结晶时当蒸发皿中有大量固体析出时停止加热.
故答为:(1)MgCl2+2NaOH=2NaCl+Mg(OH)2↓;(2)CaCO3;(3)过量的碳酸钠和氢氧化钠,蒸发皿中有大量固体析出时.
分析:(1)根据氯化镁与与氢氧化钠的反应写出反应的方程式;
(2)根据氯化钙与碳酸钠的反应分析生成的沉淀;
(3)根据溶液中含有的氢氧化钠、碳酸钠分析加入加稀盐酸的目的,根据蒸发的操作分析.
点评:本题考查综合,既考查了粗盐提纯实验的有关注意事项,又考查了如何除去粗盐中的可溶性杂质的问题,解答时要依据相关知识细心分析.

练习册系列答案
相关题目