题目内容
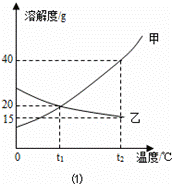
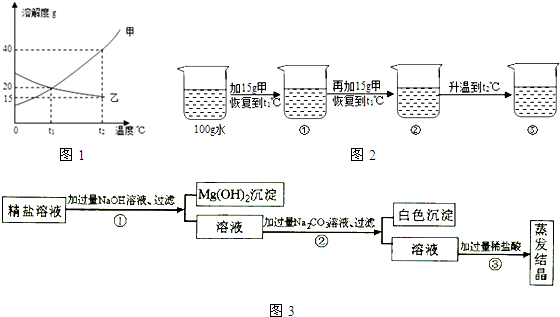
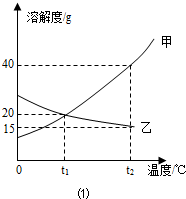
Ⅰ.如图1为甲、乙(均不含结晶水)两种固体物质的溶解度曲线.
〔1〕溶解度随温度升高而增大的物质是
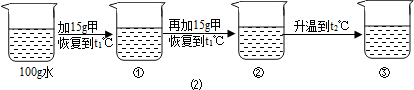
〔2〕某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.
在溶液①~③中属于饱和溶液的是
(3)在溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为
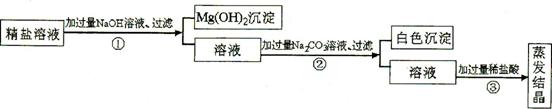
Ⅱ.某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2.小青同学设计了如图3所示实验方案来除去可溶性杂质.
(1)步骤①的化学方程式为
(2)步骤②中得到的白色沉淀是
(3)步骤③中加稀盐酸是为了除去溶液中的
〔1〕溶解度随温度升高而增大的物质是
甲
甲
(填“甲”或“乙”),t1℃时,甲的溶解度等于
等于
(填“大于”“小于”或“等于”)乙的溶解度;〔2〕某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.

在溶液①~③中属于饱和溶液的是
②
②
(填序号)、溶质质量分数最大的是③
③
(填序号);(3)在溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为
28.6%
28.6%
〔精确到0.1%〕.Ⅱ.某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2.小青同学设计了如图3所示实验方案来除去可溶性杂质.
(1)步骤①的化学方程式为
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
.(2)步骤②中得到的白色沉淀是
CaCO3
CaCO3
(填化学式).(3)步骤③中加稀盐酸是为了除去溶液中的
过量的NaOH和Na2CO3
过量的NaOH和Na2CO3
.分析:Ⅰ、(1)根据溶解度曲线和交点的含义分析解答;
(2)根据甲物质在t1℃和t2℃的溶解度结合图示分析解答;
(3)根据饱和溶液溶质质量分数的计算考虑;
Ⅱ、(1)根据氯化镁与与氢氧化钠的反应写出反应的方程式;
(2)根据氯化钙与碳酸钠的反应分析生成的沉淀;
(3)根据溶液中含有的氢氧化钠、碳酸钠分析加入加稀盐酸的目的.
(2)根据甲物质在t1℃和t2℃的溶解度结合图示分析解答;
(3)根据饱和溶液溶质质量分数的计算考虑;
Ⅱ、(1)根据氯化镁与与氢氧化钠的反应写出反应的方程式;
(2)根据氯化钙与碳酸钠的反应分析生成的沉淀;
(3)根据溶液中含有的氢氧化钠、碳酸钠分析加入加稀盐酸的目的.
解答:解:Ⅰ、(1)由曲线可知解度随温度升高而增大的物质是甲;曲线中交点表示该温度时两种物质的溶解度相等,所以t1℃时,甲的溶解度等于乙的溶解度;
(2)甲物质在t1℃溶解度为20g,即100g水中最多溶解20g,①中加入了15g,所以为不饱和溶液,②中加入了30g,所以饱和且有10g没溶解;由于甲物质在t2℃的溶解度是40g,所以升温后原来没溶解的又溶解了,且还不饱和;溶剂不变③中的溶质质量最多,所以质量分数最大;
(3)溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,只能溶解10g,即属于饱和溶液,根据饱和时质量分数的计算式
×100%,所以溶质质量分数为:
×100%=28.6%;
Ⅱ、(1)在步骤①加入的氢氧化钠能与粗盐中的氯化镁反应,生成了氢氧化镁沉淀和氯化钠,反应的方程式是:MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(2)步骤②中加入的碳酸钠能与氯化钙反应生成了CaCO3沉淀和氯化钠;
(3)由于溶液中存在过量的氢氧化钠、碳酸钠.所以,骤③中加稀盐酸是为了除去溶液中的过量的碳酸钠和氢氧化钠;
故答案为:Ⅰ、(1)甲; 等于; (2)②;③;(3)28.6%;
Ⅱ、(1)MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(2)CaCO3;
(3)过量的NaOH和 Na2CO3.
(2)甲物质在t1℃溶解度为20g,即100g水中最多溶解20g,①中加入了15g,所以为不饱和溶液,②中加入了30g,所以饱和且有10g没溶解;由于甲物质在t2℃的溶解度是40g,所以升温后原来没溶解的又溶解了,且还不饱和;溶剂不变③中的溶质质量最多,所以质量分数最大;
(3)溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,只能溶解10g,即属于饱和溶液,根据饱和时质量分数的计算式
| 溶解度 |
| 溶解度+100g |
| 40g |
| 140g |
Ⅱ、(1)在步骤①加入的氢氧化钠能与粗盐中的氯化镁反应,生成了氢氧化镁沉淀和氯化钠,反应的方程式是:MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(2)步骤②中加入的碳酸钠能与氯化钙反应生成了CaCO3沉淀和氯化钠;
(3)由于溶液中存在过量的氢氧化钠、碳酸钠.所以,骤③中加稀盐酸是为了除去溶液中的过量的碳酸钠和氢氧化钠;
故答案为:Ⅰ、(1)甲; 等于; (2)②;③;(3)28.6%;
Ⅱ、(1)MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(2)CaCO3;
(3)过量的NaOH和 Na2CO3.
点评:本题考查综合,解答本题关键是要知道交点的含义,溶解度的大小比较,饱和溶液的判断方法和溶质质量分数的计算,及粗盐提纯实验如何除去粗盐中的可溶性杂质的问题,解答时要依据相关知识细心分析.

练习册系列答案
相关题目


 或“等于”)乙的溶解度;
或“等于”)乙的溶解度;